
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作____。
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。


(3)能说明SO2具有氧化性的实验现象为_________________。
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________。
【答案】打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加 a试管中有淡黄色沉淀生成 III SO2+Cl2+2H2O===4H++SO42-+2Cl-
【解析】
(1)要让分液漏斗内的液体流出,漏斗内的压强不能小于烧瓶内的压强,所以应打开分液漏斗上口的塞子,并旋开分液漏斗的旋塞。
(3)证明二氧化硫具有氧化性,可以使另一物质中某元素的价态升高,根据题中提供的物质,只能选择最低价态的硫化钠。
(4)方案Ⅰ:向第一份溶液加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,可能是SO42-的作用;
方案Ⅱ:向第二份溶液加入品红溶液,红色退去,可能是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的。
(1)分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加。答案:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
(3)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S。答案为:a试管中有淡黄色沉淀生成;
(4)方案Ⅰ:向第一份溶液加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,不能证明二氧化硫具有还原性,此方案不合题意;
方案Ⅱ:向第二份溶液加入品红溶液,红色退去,可能是氯水中含有的漂白性物质次氯酸起的作用,此方案不合题意;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O==4H++SO![]() +2Cl-,S元素的化合价升高,体现二氧化硫的还原性,此实验设计合理,符合题意。答案为:III;SO2+Cl2+2H2O==4H++SO42-+2Cl-。
+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,此实验设计合理,符合题意。答案为:III;SO2+Cl2+2H2O==4H++SO42-+2Cl-。


科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是( )
A. 在任何条件下,化学平衡常数K是一个恒定值
B. 平衡常数K只与温度有关,与反应物浓度、压强无关
C. 从平衡常数K的大小不能推断一个反应进行的程度
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列自然现象发生或形成的过程中,指定元素既没有被氧化又没有被还原的是
|
|
|
|
A.溶洞——钙 | B.闪电——氮 | C.火山喷发——硫 | D.光合作用——碳 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与图示相符的是( )
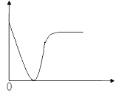
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标是钠离子的物质的量)
B.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
C.NaOH溶液滴入Ba(HCO3)2溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
D.铁粉加入到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和溶液中:①溶液的质量;②溶剂的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度,从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
A.④⑤⑥B.①②③④C.①②④⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸、盐酸和碳酸钠是生活中常见的物质。
(1)碳酸钠水溶液显碱性的原因是(用离子方程式表示)______。
(2)25℃时,体积相同,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确是_____。
a.两溶液的pH相同
b.两溶液中由水电离出的c(OH-)相同
c.两溶液分别与足量的金属Mg反应,产生的H2体积相同
d.两溶液中分别加入NaOH至中性,消耗NaOH物质的量相同
(3)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是______。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不正确的是___。
CH3COO-+H+,下列叙述不正确的是___。
a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO)
b.0.1mol·L-1的CH3COOH 溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com