
| A. |  图中△H1=△H2+△H3 | |
| B. |  如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. |  如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
分析 A、根据盖斯定律的含义来回答;
B、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能;
C、醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;
D、未指明是几摩尔CO燃烧放出566kJ的热量.
解答 解:A、根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,故A错误;
B、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故B错误;
C、氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故C正确;
D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,故D错误;
故选C.
点评 本题考查了盖斯定律的应用,活化能概念应用,反应焓变的意义以及溶液的导电性等问题,难度不大.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.01 mol•L-1 | D. | 10 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c(CH3COOH)+c (H+)=c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c (K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c (H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
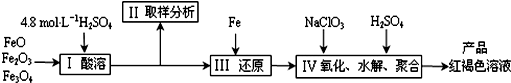
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卢瑟福原子模型 | B. | 电子云模型 | C. | 汤姆生原子模型 | D. | 玻尔原子模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值减小 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:[c(CO32-)>c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1 和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 1、1 | C. | 2、1 | D. | 2、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、6、8、14 | B. | 4、6、8、15 | C. | 5、6、8、14 | D. | 4、5、6、8、14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com