
| A、原混合物中氢氧化铁的质量分数可能为70% |
| B、所需0.5 mol?L-1 H2SO4 溶液的体积为600mL |
| C、原混合物中硫化亚铁的质量分数可能为25% |
| D、反应中转移电子物质的量为0.4mol |
| 3.2g |
| 32g/mol |
| 26.4 |
| 35.2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 26.4g |
| 88g/mol |
| n |
| c |
| 0.45mol |
| 0.5mol/L |
| 3.2g |
| 32g/mol |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不含NO3-,可能含Fe3+ |
| B、含有NO3-、I-、Cl- |
| C、含I-,但不能确定是否含Cl- |
| D、不含有NO3-和Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
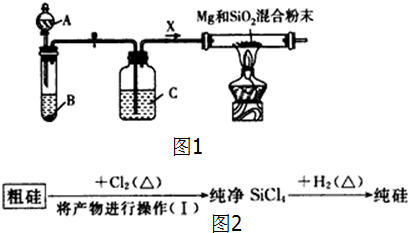
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、49 | B、16 | C、36 | D、42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验SO2中是否混有CO2,将气体通过澄清的石灰水变浑浊,则说明一定含CO2 |
| B、加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
| C、加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42- |
| D、检验K+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,直接观察火焰呈紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com