
【题目】已知NH4HCO3受热易分解,化学方程式NH4HCO3=NH3↑+CO2↑+H2O。发酵粉是制作糕点的常见膨胀剂,某发酵粉的主要成分是NH4HCO3、NaHCO3,某学生称取干燥的此发酵粉50g,充分加热至质量不再改变,称取残留固体质量26.5g,该发酵粉中NaHCO3与NH4HCO3的质量比为( )
A.4:21B.8:21C.21:4D.84:79
【答案】C
【解析】
NH4HCO3受热易分解生成氨气、水蒸气和CO2,均为气体,加热后无固体生成,NaHCO3受热分解生成碳酸钠,水和CO2,因此称取干燥的此发酵粉50g,充分加热至质量不再改变,称取残留固体质量26.5g,残留固体为Na2CO3,根据碳酸钠的质量计算碳酸氢钠的质量,进一步计算碳酸氢铵的质量,再求质量之比。
由分析可知,残留固体为Na2CO3,其质量为26.5g,设碳酸氢钠的质量为xg,那么:
2NaHCO3 ![]() Na2CO3 + CO2↑+H2O
Na2CO3 + CO2↑+H2O
![]()
![]()
![]() 解得x=42g,那么发酵粉中碳酸氢铵的质量为50-42=8g,因此发酵粉中NaHCO3与NH4HCO3的质量比为42:8=21:4;
解得x=42g,那么发酵粉中碳酸氢铵的质量为50-42=8g,因此发酵粉中NaHCO3与NH4HCO3的质量比为42:8=21:4;
答案选C。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Al ![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
B.NaCl(aq) ![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
C.CuCl2 ![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
D.MgO(s) ![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:b. ___________。
(2)仪器c使用前必须_________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_________。
(4)用质量分数为98%、密度为1.84 g/cm3的浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4。
①装置Ⅱ是某同学转移溶液的示意图,图中的错误是_____________________。除了图中给出的的仪器外,为完成实验还需要的仪器有:___________________。
②根据计算得知,需量取该浓H2SO4的体积为_______________mL。
(5)下列操作,会使所配制的溶液浓度偏大的是____________。
①容量瓶中原来含有少量蒸馏水;
②在未降至室温时,立即将溶液转移至容量瓶定容
③定容转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度
④定容时俯视刻度线;
⑤用量筒量取98%的硫酸时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时500 mL水中溶解了112L氯化氢气体(在标准状况下测得)。下列关于所形成溶液的说法中正确的是( )
A.该溶液溶质的物质的量浓度为10mol·L1
B.该溶液溶质的质量分数约为26.7%
C.该溶液溶质的物质的量浓度因溶液的密度未知而无法求得
D.该溶液溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________,其晶体属于____________晶体。
(2)乙的水溶液可以用来做________________________(写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为_____。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________。
甲的制备过程中氨气需要过量的理由是____________________________________。
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于____________(忽略丁的二级电离和H2O的电离)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO2、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
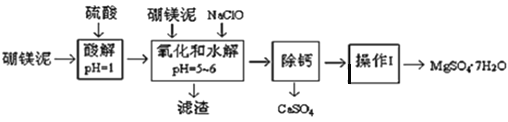
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有_________________。(写2个)
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据如图给出的装置图回答下列问题:
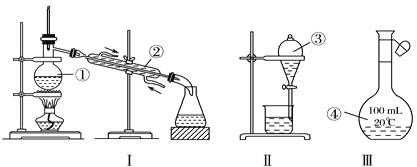
(1)写出图中玻璃仪器的名称:①____;②____;③_____。
(2)①~④中,使用前必须检查是否漏水的是___、___(填仪器序号),分离溴水中的溴应先选择装置___(填Ⅰ、Ⅱ或Ⅲ序号)。
Ⅱ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、___、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为___克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水___2次~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度___处,改用胶头滴管加水,使溶液___。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是____(填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com