
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%~0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
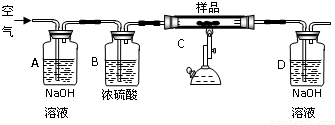
分析 (1)根据铁的活泼性和其氧化物的性质来判断;
(2)磁性氧化铁是四氧化三铁,生成四氧化三铁的反应有铁在氧气中点燃和铁在水蒸气下高温反应制得;
(3)①根据实验目的回答;
②根据实验原理,D装置质量增加0.33g即生成的二氧化碳的质量,再根据碳守恒计算;
③没有AB,则二氧化碳变大,则含碳量变大.
解答 解:(1)根据铁在空气中易被氧化,故铁是以化合态存在;其氧化物呈黑色的是FeO、Fe3O4,氧化物中颜色是红色的是Fe2O3,故答案为:化合;FeO、Fe3O4;Fe2O3;
(2)磁性氧化铁是四氧化三铁,生成四氧化三铁的反应有3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)①根据实验原理分析,进入样品的空气不能含二氧化碳和水蒸气,所以AB的作用就是除去空气中的二氧化碳和水蒸气,故答案为:除去空气中的二氧化碳和水蒸气;
②根据实验原理,D装置质量增加0.33g即生成的二氧化碳的质量,再根据碳守恒则样品中的碳的质量为:$\frac{033}{44}$×12=0.09g,碳的质量分数为$\frac{0.09}{25}$×100%=0.36%
所以为中碳钢,故答案为:中碳;
③没有AB,则二氧化碳偏大,则含碳量偏高,故答案为:偏高.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,中计算关键清楚个阶段发生的反应,注意利用守恒思想解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸分子都能和金属钠反应 | |
| B. | 乙酸能溶于水,但不溶于乙醇 | |
| C. | 乙醇和乙酸均能使紫色石蕊试液变红 | |
| D. | 乙醇和乙酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①戊烷②丙烷③丁烷沸点高低顺序为①>③>② | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | CH2=CH2+H2O→CH3-CH2OH 是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 将氯气通入碱溶液中:Cl2+OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
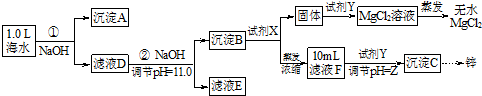
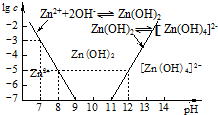
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com