
| A. | ①戊烷②丙烷③丁烷沸点高低顺序为①>③>② | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | CH2=CH2+H2O→CH3-CH2OH 是加成反应 |
分析 A.烷烃的沸点随着相对分子质量的增加而升高,一般来说分子中碳数越多,沸点越高;对于含碳数相同的烷烃而言,支链越多,沸点越低;
B.CH4与Cl2以体积比1:4混合可得到多种氯代烃;
C.苯可发生加成反应;
D.反应中C=C键变为C-C.
解答 解:A.烷烃的沸点随着相对分子质量的增加而升高,一般来说分子中碳数越多,沸点越高;对于含碳数相同的烷烃而言,支链越多,沸点越低,则①戊烷②丙烷③丁烷沸点高低顺序为①>③>②,故A正确;
B.CH4和Cl2光照生成CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等物质,反应中Cl2不断消耗,又有部分氯气溶解在生成的CH2Cl2、CHCl3、CCl4中,不能得到纯净的CCl4,故B错误;
C.苯可发生加成反应,可与氢气发生加成反应生成环己烷,故C正确;
D.反应中C=C键变为C-C,属于加成反应,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握物质的性质、有机反应、有机物组成等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否完全水解:取少量水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,看是否有砖红色沉淀生成 | |
| B. | 提纯混有少量CaCl2的NaCl固体:将固体配成溶液,加入稍过量Na2CO3溶液至沉淀完全,过滤,再向滤液中加入稍过量盐酸,蒸发结晶 | |
| C. | 制取少量乙酸乙酯:向试管中加入浓硫酸,再加入无水乙醇,冷却后加入冰醋酸,加热,将生成的蒸气导至盛有氢氧化钠溶液的试管中 | |
| D. | 验证炭与浓硫酸反应产生的CO2:将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 硫酸钠溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 盐酸滴在石灰石上:CaCO3+2H+═H2CO3+Ca2+ | |
| D. | 氧化铜与硫酸混合:Cu2++SO42-═CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
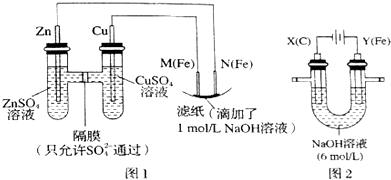
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(OH-)>c (H2S) | B. | c (Na+)+c (H+)=c (S2-)+c (OH-)+c (HS-) | ||
| C. | 2c (Na+)=c (S2-)+c (H2S)+c (HS-) | D. | c(Na+)>c(S2-)>c(OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%~0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
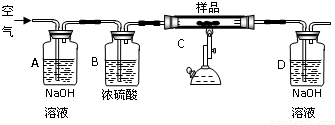
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe (OH )3;Fe2O3 | B. | Fe (OH)2; FeO、Fe (OH)2 | ||
| C. | Fe (OH)3;Fe3O4 | D. | Fe2O3;Fe (OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液导电性良好,所以氯气是强电解质 | |
| B. | NaCl溶液在电流作用下电离成Na+和Cl- | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应不一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 由锌、铜、稀硫酸构成的原电池溶液中加入适量的H2O2能提高电池的放电效率 | |
| D. | 在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,若无砖红色沉淀产生,则淀粉未发生水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com