
【题目】短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
【答案】A
【解析】
W的一种核素在考古时常用来鉴定一些文物的年代,用的是14C,则W为C元素;X2-和Y2+具有相同的电子层结构,X为O元素、Y为Mg元素,Z原子的最外层电子数是其电子层数的2倍,应为S元素,由以上分析可知W为C元素、X为O元素、Y为Mg元素、Z为S元素;
A.X为O元素,与H元素可以形成过氧化氢,过氧化氢的电子式为![]() ,可知过氧化氢中,H元素与O元素形成极性共价键,O元素与O元素形成非极性共价键,因而过氧化氢中既含有极性键也含有非极性键,故A错误;
,可知过氧化氢中,H元素与O元素形成极性共价键,O元素与O元素形成非极性共价键,因而过氧化氢中既含有极性键也含有非极性键,故A错误;
B.Y为镁元素,工业上用电解熔融的氯化镁的方法冶炼镁,故B正确;
C.W为C元素,C元素与H元素可形成苯(C6H6)和乙炔(C2H2)等化合物,它们的C、H原子比为1:1,故C正确;
D.W为C元素,Z为S元素,形成WZ2即CS2,在CS2中C元素显+4价,C元素最外层4个电子,则CS2中C最外层电子数为4+4=8,满足8电子稳定结构,S元素显-2价,S元素最外层电子数为6,则CS2中S最外层电子数为2+6=8,满足8电子稳定结构,因而各原子均满足8电子稳定结构,故D正确;
答案为A。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的容器中发生反应:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A)∶n(B)∶n(C)∶n(D)=1∶3∶2∶2 ⑥B的浓度不变
A. ②③⑤⑥ B. ①③④⑥ C. ②④⑤ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
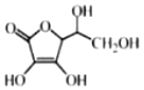
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确旳是 ( )
A.碳酸氢铵和足量旳氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+
C.用稀硝酸浸泡做过银镜反应旳试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.偏铝酸钠溶液中通入过量旳二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主法错误的是
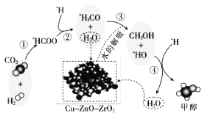
A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol): ______;
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
①实验时所需要的玻璃仪器除烧杯、量筒外还需要:____。
②该装置中有一处错误是:_____。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广州大学附属东江中学“探源致善”化学兴趣小组采用下面的实验装置图制备纯净的氯气,根据相关知识填空:
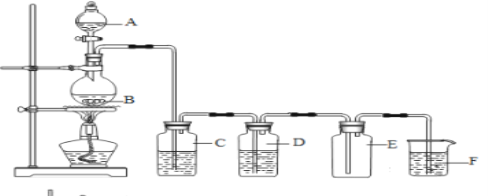
(1)A仪器的名称是_________________,B中发生的化学方程式为__________________________
(2)装置C中盛放的试剂是__________,装置F中的离子方程式为__________________________
(3)氯气溶于水制得氯水,请设计实验验证干燥的氯气无漂白性、新制的氯水具有酸性与漂白性(写出必要的实验步骤与实验现象)_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com