
【题目】广州大学附属东江中学“探源致善”化学兴趣小组采用下面的实验装置图制备纯净的氯气,根据相关知识填空:
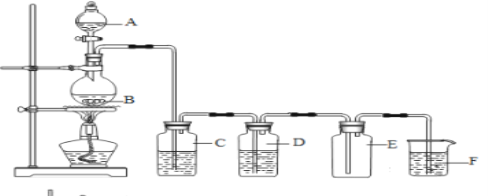
(1)A仪器的名称是_________________,B中发生的化学方程式为__________________________
(2)装置C中盛放的试剂是__________,装置F中的离子方程式为__________________________
(3)氯气溶于水制得氯水,请设计实验验证干燥的氯气无漂白性、新制的氯水具有酸性与漂白性(写出必要的实验步骤与实验现象)_________________________________________
【答案】分液漏斗 MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + H2O 饱和食盐水 Cl2 + 2OH- == Cl- + ClO- + H2O 将干燥的蓝色石蕊试纸、湿润的蓝色石蕊试纸先后浸入充满氯气的集气瓶中,干燥的蓝色石蕊试纸无现象,湿润的蓝色石蕊试纸先变红后褪色
【解析】
装置A中盛放浓盐酸与装置B中的二氧化锰在加热条件下生成氯气,C中盛饱和食盐水除去氯气中的氯化氢,D中盛浓硫酸干燥氯气,E装置用向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余氯气。
(1)根据装置图,可知A仪器的名称是分液漏斗,B中二氧化锰和浓盐酸在加热条件下生成氯化锰、氯气、水,发生的化学方程式为MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + H2O;
(2)装置C的作用是除去氯气中的氯化氢,C中盛放的试剂是饱和食盐水,装置F中盛放氢氧化钠,氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水,反应的离子方程式为Cl2 + 2OH- = Cl- + ClO- + H2O;
(3)干燥的氯气不能使干燥的蓝色石蕊试纸褪色说明氯气没有漂白性,氯气使湿润的蓝色石蕊试纸先变红后褪色,因为氯水有酸性所以试纸变红,次氯酸具有漂白性,所以试纸褪色。验证干燥的氯气无漂白性、新制的氯水具有酸性与漂白性的操作是:将干燥的蓝色石蕊试纸、湿润的蓝色石蕊试纸先后浸入充满氯气的集气瓶中,干燥的蓝色石蕊试纸无现象,湿润的蓝色石蕊试纸先变红后褪色。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案I:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________________。
方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池的装置图_________,标出原电池的电极材料和电解质溶液,并写出负极电极反应式负极反应式: ________________。

方案III;结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案1、II不能雷同) ________________用离子方程式表示其反应原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.某温度下,78 g ![]() 与适量的
与适量的![]() 恰好完全反应,转移的电子数为
恰好完全反应,转移的电子数为![]()
B.苯与液溴反应生成1 mol溴苯,消耗0.5![]() 个
个![]()
C.![]() 的
的![]() 溶液中,含有
溶液中,含有![]() 的数目为
的数目为![]()
D.100 g 46%的乙醇溶液中,含H—O键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验结果的是( )
编号 | A | B | C | D |
实验方案 |
|
片刻后在 |
|
置于光亮处 |
实验结果 | 铁钉发生析氢反应 |
| 左球气体颜色加深; 右球气体颜色变浅 | 甲烷与氯气发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中以废铁屑为原料来制备,步骤如下:
步骤1:将铁屑放入与铁不反应的洗涤剂去除铁表面的油污,分离出液体,洗净铁屑
步骤2:向处理过的铁屑中加入过量的稀硫酸 溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中的分离操作,所用到的玻璃仪器有____________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)为确认晶体中Fe2+在制备过程中没有被氧化,请你设计简单的实验方案进行验证(写出简单的实验过程、实验现象及结论)_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物的分离提纯在生产生活中有着重要的意义,请根据题目要求完成下题:
已知某工业废水中含有大量FeSO4,较多的Cu2+,以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
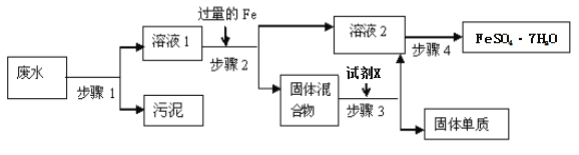
(1)步骤1的主要操作中需用到的玻璃仪器有____,____,_____。
(2)步骤2中发生反应的离子方程式为_____。
(3)步骤3中加入的试剂X为_____。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、烘干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com