
【题目】甲醛( HCHO)在化工、医药、农药等方面有着广泛的应用。
(1)甲醇脱氢法可制备甲醛,同时生成副产物CO等,已知以下热化学方程式:
CH3OH(1) ![]() HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
CH3OH(g) ![]() CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CH3OH(1) ![]() CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
①CH3OH(g) ![]() HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2。已知:C—H键键能为413 kJ·mol-1;O—H键键能为463kJ·mol-1,试将可能性较大的转化过程补充完整:
CH3OH=·H+·CH2OH或CH3OH=·H + CH3O·;
_____=____+ HCHO;
________=3_______+ CO;
·H+·H=H2;
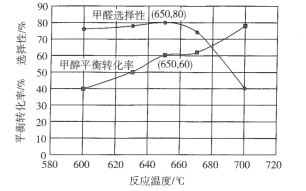
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为__________;温度高于650℃,甲醛选择性迅速降低,原因是___________。按只发生反应( II )和( IV)两个平行反应,在650℃平衡时体系总压强为p,则该温度下反应(IV)的压强平衡常数Kp=__________(列出算式即可)。
(2)市售甲醛溶液含量的测定方法如下(已知:HCHOO+ H2O2=HCOOH + H2O、HCOOH + NaOH=HCOONa + H2O):
①向盛有10mL水的锥形瓶中滴入mg甲醛溶液样品,加过氧化氢溶液25mL(过量)与溴麝香草酚蓝指示液2滴,再加入1 molL-1氢氧化钠溶液25 mL,剩余的NaOH用1 molL-1盐酸滴定至溶液显黄色,消耗盐酸V1mL。
②空白实验:向盛有10mL水的锥形瓶中加过氧化氢溶液25mL与溴麝香草酚蓝指示液2滴,再加入1molL-1氢氧化钠溶液25mL,用1molL-1盐酸滴定至溶液显黄色,消耗盐酸V2mL。则甲醛溶液样品中甲醛的质量分数为______(用含m、V1、V2的代数式表示)。
【答案】+96.5 CH2OH H CH2OH H 甲醇脱氢反应是吸热反应,温度升高,平衡右移,促进反应逬行 高温导致甲醛分解等副反应加剧,同时甲醇高温下生成CO在热力学上更有利 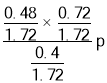 (或
(或![]() 或0.50p)
或0.50p) ![]()
【解析】
(1)①将第2个方程式减去第3个方程式,再加上第1个方程式得到CH3OH(g) ![]() HCHO(g) +H2(g)的焓变;②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2;③根据图中信息及甲醇脱氢反应是吸热反应,温度升高,平衡右移;温度高于650℃是高温导致甲醛分解等副反应,同时甲醇高温下生成CO在热力学上更有利,按只发生反应(II)和(IV)两个平行反应,在650℃平衡时体系总压强为p,设开始反应物为1mol,根据甲醇的转化率和甲醛的选择性,建立三段式计算,计算得到该温度下反应(IV)的压强平衡常数。
HCHO(g) +H2(g)的焓变;②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2;③根据图中信息及甲醇脱氢反应是吸热反应,温度升高,平衡右移;温度高于650℃是高温导致甲醛分解等副反应,同时甲醇高温下生成CO在热力学上更有利,按只发生反应(II)和(IV)两个平行反应,在650℃平衡时体系总压强为p,设开始反应物为1mol,根据甲醇的转化率和甲醛的选择性,建立三段式计算,计算得到该温度下反应(IV)的压强平衡常数。
(2)根据实验及空白实验分析得到HCOOH消耗的氢氧化钠的物质的量,得到n(HCHO)并计算甲醛溶液样品中甲醛的质量分数。
(1)①将第2个方程式减去第3个方程式,再加上第1个方程式得到CH3OH(g) ![]() HCHO(g) +H2(g) △H4=+94.6 kJ·mol1 –(+127.9 kJ·mol1)+( +129.8 kJ·mol1)= +96.5 kJ·mol1;故答案为:+96.5。
HCHO(g) +H2(g) △H4=+94.6 kJ·mol1 –(+127.9 kJ·mol1)+( +129.8 kJ·mol1)= +96.5 kJ·mol1;故答案为:+96.5。
②根据自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2,再根据题中信息得到 CH2OH = H + HCHO;CH3O = 3H+ CO;H+H=H2;故答案为:CH2OH;H;CH3O;H。
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为甲醇脱氢反应是吸热反应,温度升高,平衡右移,促进反应进行;温度高于650℃,甲醛选择性迅速降低,原因是高温导致甲醛分解等副反应加剧,同时甲醇高温下生成CO在热力学上更有利。按只发生反应( II )和( IV)两个平行反应,在650℃平衡时体系总压强为p,设开始反应物为1mol,根据甲醇的转化率和甲醛的选择性,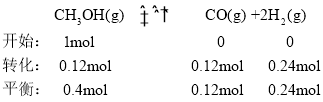 ,
,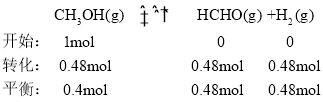 ,则该温度下反应(IV)的压强平衡常数
,则该温度下反应(IV)的压强平衡常数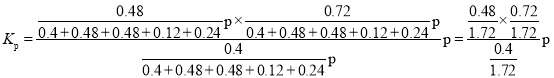 ;故答案为:甲醇脱氢反应是吸热反应,温度升高,平衡右移,促进反应进行;高温导致甲醛分解等副反应加剧,同时甲醇高温下生成CO在热力学上更有利;
;故答案为:甲醇脱氢反应是吸热反应,温度升高,平衡右移,促进反应进行;高温导致甲醛分解等副反应加剧,同时甲醇高温下生成CO在热力学上更有利;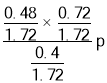 (或
(或![]() 或0.50p)。
或0.50p)。
(2)根据实验及空白实验分析得到HCOOH消耗的氢氧化钠的物质的量n(NaOH)= 1 molL-1×(V2 V1)×103L= (V2 V1)×103mol,则HCOOH及HCHO的物质的量n(HCHO)=n(HCOOH)=n(NaOH)= (V2 V1)×103 mol,甲醛溶液样品中甲醛的质量分数为![]() ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
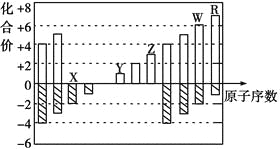
A.离子半径:Y>Z>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看到儿童手持荧光棒嬉戏,魔棒发光原理是利用H2O2氧化草酸二酯(CPPO)产生能量,该能量被传递给荧光物质后发出荧光.草酸二酯结构简式如图所示,下列有关草酸二酯的说法不正确的是( )

A. 草酸二酯与H2完全反应,需要6mol H2
B. 草酸二酯的分子式为C26H24O8Cl6
C. 草酸二酯能发生加成反应、取代反应和氧化反应
D. 1mol草酸二酯最多可与4mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式如图所示,下列关于邻二乙烯苯的说法不正确的是
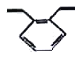
A.1 mol邻二乙烯苯含有5 mol碳碳双键
B.所有的原子可能在同一平面
C.能发生加成反应,也能发生取代反应
D.苯环上的二氯代物有4种(不考虑立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式___________________。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+178 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-743kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=_______kJ·mol-1
(3)在一固定容积为2L的密闭容器内加入1.5 mol的N2和5 mol的H2,在一定条件下发生如下反应:N2+3H2![]() 2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
(4)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____;在压强一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d. 混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com