
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】甲醛( HCHO)在化工、医药、农药等方面有着广泛的应用。
(1)甲醇脱氢法可制备甲醛,同时生成副产物CO等,已知以下热化学方程式:
CH3OH(1) ![]() HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
CH3OH(g) ![]() CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CH3OH(1) ![]() CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
①CH3OH(g) ![]() HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2。已知:C—H键键能为413 kJ·mol-1;O—H键键能为463kJ·mol-1,试将可能性较大的转化过程补充完整:
CH3OH=·H+·CH2OH或CH3OH=·H + CH3O·;
_____=____+ HCHO;
________=3_______+ CO;
·H+·H=H2;
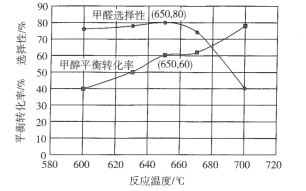
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为__________;温度高于650℃,甲醛选择性迅速降低,原因是___________。按只发生反应( II )和( IV)两个平行反应,在650℃平衡时体系总压强为p,则该温度下反应(IV)的压强平衡常数Kp=__________(列出算式即可)。
(2)市售甲醛溶液含量的测定方法如下(已知:HCHOO+ H2O2=HCOOH + H2O、HCOOH + NaOH=HCOONa + H2O):
①向盛有10mL水的锥形瓶中滴入mg甲醛溶液样品,加过氧化氢溶液25mL(过量)与溴麝香草酚蓝指示液2滴,再加入1 molL-1氢氧化钠溶液25 mL,剩余的NaOH用1 molL-1盐酸滴定至溶液显黄色,消耗盐酸V1mL。
②空白实验:向盛有10mL水的锥形瓶中加过氧化氢溶液25mL与溴麝香草酚蓝指示液2滴,再加入1molL-1氢氧化钠溶液25mL,用1molL-1盐酸滴定至溶液显黄色,消耗盐酸V2mL。则甲醛溶液样品中甲醛的质量分数为______(用含m、V1、V2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的固定和转化是世界性课题。兰州大学最欢旺教授团队巧妙设计构建了系列新型光电催化人工光合成体系——光电催化池,p-n半导体异质结催化CO2在水中直接制备长碳链有机物并放出氧气,原理如下图:
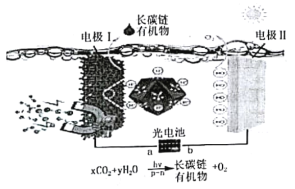
下列说法不正确的是
A.电极Ⅰ的电势比电极Ⅱ的电势高
B.该设计向大自然学习,模仿植物的光合作用
C.电子从a极流到电极I,从电极Ⅱ流到b极
D.负极区,p-n为催化剂,CO2发生还原反应生成长碳链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》指出,冠状病毒对紫外线和热敏感,含氯消毒剂过氧乙酸等脂溶剂均可有效灭活病毒,但氯已定不能有效灭活病毒。氯已定又名洗必泰,化学名为双氯苯双胍已烷,系阳离子表面活性剂,具有相当强的广谱抑菌、杀毒作用,其结构如图所示。下列关于氯己定的说法中正确的是
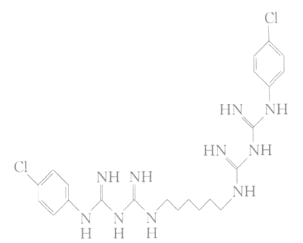
A.其分子式为C22H30Cl2N10
B.其苯环上的一溴代物有四种
C.一定条件下,氯已定最多可与6mol氢气加成
D.一定条件下,氯已定可发生加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是元素周期表的轮廓图,根据元素①~⑩在周期表中的位置,按题目要求回答问题:
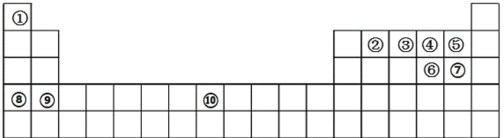
(1)元素①、②能形成 16 电子的分子,该分子的电子式为________________, 元素①、③能形成 10 电子的分子,请用电子式表示该物质的形成过程_______________________;
(2)元素④、⑤、⑥形成的简单氢化物的热稳定性从小到大顺序为___________________(用化学式表示);
(3)将过量的元素⑩单质加入到元素③最高价氧化物水化物的稀溶液中,发生反应的离子反应方程式为_______;
(4)铅元素在元素周期表中的位置为________________,铅酸蓄电池是典型的二次电池,在生活中有广泛的应用,其放电时正极的电极反应式为________________,放电一段时间后,正极质量增加 6.4g,则这段时间,转移电子物质的量为__________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是___________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
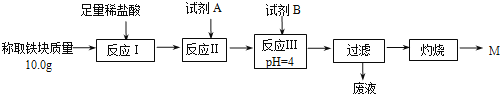
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
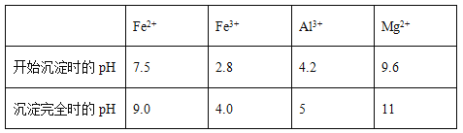
① 试剂A应选择________,试剂B应选择_______(填序号)。
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式____________________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4__________。

④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是_______。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______对自旋方向相反的电子。
(2)丙酮(![]() )分子中,中间碳原子的杂化方式为______;
)分子中,中间碳原子的杂化方式为______;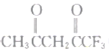 中
中![]() 键和π键的数目之比为__________________.
键和π键的数目之比为__________________.
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体;Fe3+的核外电子排布式为__________________。
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________。分子中的大π键用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则CO32-中的大π键应表示为____________。
),则CO32-中的大π键应表示为____________。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
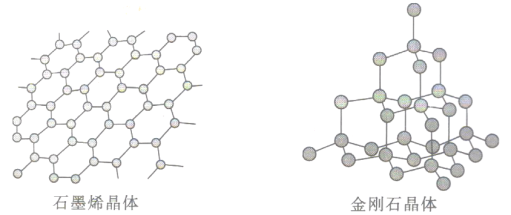
①在石墨烯晶体中,一个六元环上的C原子数为__________________。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有_______个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积均为20.00 mL、浓度均为0.1 mol·L-1的HX溶液和HY溶液,分别向其中滴加相同浓度的NaOH溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是
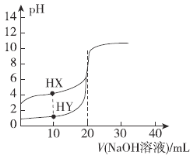
A.该滴定过程的指示剂为酚酞溶液
B.V=20.00 mL时,c(HX)+c(X-)=c(Y-)
C.pH=7时,两种溶液中c(X-)=c(Y-)
D.若HX溶液起始pH=3,则常温下HX的Ka≈1.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com