
【题目】常温下,有体积均为20.00 mL、浓度均为0.1 mol·L-1的HX溶液和HY溶液,分别向其中滴加相同浓度的NaOH溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是
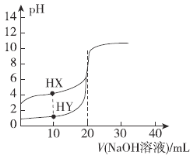
A.该滴定过程的指示剂为酚酞溶液
B.V=20.00 mL时,c(HX)+c(X-)=c(Y-)
C.pH=7时,两种溶液中c(X-)=c(Y-)
D.若HX溶液起始pH=3,则常温下HX的Ka≈1.0×10-5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式___________________。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+178 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-743kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=_______kJ·mol-1
(3)在一固定容积为2L的密闭容器内加入1.5 mol的N2和5 mol的H2,在一定条件下发生如下反应:N2+3H2![]() 2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
(4)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____;在压强一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d. 混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是( )
2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大环多醚称为冠醚。二苯并-18-冠-6的结构简式如图所示。下列说法不正确的是
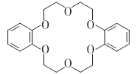
A.该有机物的分子式为C20H24O6
B.该有机物中所有原子不可能共平面
C.在光照下,该有机物与氯气反应的一氯代物有4种(不考虑立体异构)
D.1 mol该有机物的苯环最多可与6 mol H2发生加成反应(不考虑开环加成)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列问题。
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | (11) | ⑧ | ⑩ | ||||
三 | ① | ③ | ⑤ | ⑦ | (12) | ⑨ | ||
四 | ② | ④ |
(1)在这12种元素中,化学性质最不活泼的元素名称是______,得电子能力最强的原子是_____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是_____(写化学式)。
(2)
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ______。
(4)请写出:
(ⅰ) ③的单质置换出⑥的单质的化学方程式:_________________________。
(ⅱ) ⑤和(11)两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________。
(ⅲ)元素⑨的单质和元素①的最高价氧化物对应的水化物常温下反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
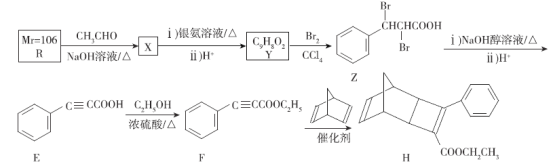
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
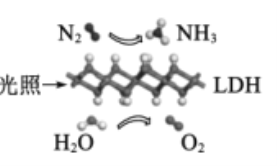
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
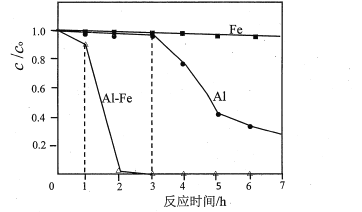
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com