
����Ŀ���±�ΪԪ�����ڱ���һ���֣������г�12��Ԫ�������ڱ��е�λ�ã���Ҫ��ش��������⡣
����\�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | (11) | �� | �� | ||||
�� | �� | �� | �� | �� | (12) | �� | ||
�� | �� | �� |
(1)����12��Ԫ���У���ѧ��������õ�Ԫ��������______���õ���������ǿ��ԭ����_____(��Ԫ�ط��ű�ʾ)��Ԫ�آߵ�����������Ӧ��ˮ������_____(д��ѧʽ)��
(2)
(3)�٢������Ԫ�ص������Ӱ뾶�ɴ�С��˳����(����Ӧ�����ӷ��ű�ʾ) ______��
(4)�����
(��) �۵ĵ����û����ĵ��ʵĻ�ѧ����ʽ��_________________________��
(��) �ݺ�(11)����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ___________��
(��)Ԫ�آ�ĵ��ʺ�Ԫ�آٵ�����������Ӧ��ˮ���ﳣ���·�Ӧ�Ļ�ѧ����ʽΪ__��
���𰸡��� F H3PO4 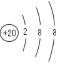
![]() Cl-�� F-��Na+
Cl-�� F-��Na+ ![]() Al(OH)3+3H+=Al3++3H2O Cl2+2NaOH=NaCl+NaClO+H2O
Al(OH)3+3H+=Al3++3H2O Cl2+2NaOH=NaCl+NaClO+H2O
��������
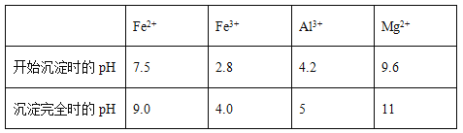
�������ڱ��е�λ�ã���Ԫ��Ϊ����ΪNa��ΪK��ΪMg��ΪCa��ΪAl��ΪC��ΪP��ΪF��ΪCl��ΪNe(11)ΪN(12)ΪS��
(1)����12��Ԫ���У�NeΪϡ�����壬�����Ϊ8���ӵ��ȶ��ṹ����ѧ��������õ�Ԫ���������ʣ��ǽ�������ǿ����F�����Եõ���������ǿ��ԭ����F��Ԫ�آ�ΪP������������Ӧ��ˮ������H3PO4���ʴ�Ϊ���ʣ�F��H3PO4��
(2)Ԫ�آ�Ϊ20��Ԫ�ظƣ�������4�����Ӳ㣬�Ƶ����ӽṹʾ��ͼΪ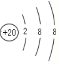 ��������γɵĻ�����Ϊ����þ�������ӻ��������ʽ��
��������γɵĻ�����Ϊ����þ�������ӻ��������ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��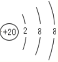 ��
��![]() ��
��
(3)��ΪNa��ΪF��ΪCl���ȱȷ���һ�����Ӳ㣬�뾶Cl-��F-��F-��Na+���Ӳ�ṹ��ͬ���˵�ɴ�İ뾶С���뾶F-��Na+������Ԫ�ص������Ӱ뾶�ɴ�С��˳����(����Ӧ�����ӷ��ű�ʾ) Cl-��F-��Na+���ʴ�Ϊ��Cl-��F-��Na+��
(4)(��) �۵ĵ����û����ĵ��ʣ���þ�ڶ�����̼��ȼ����������þ��̼����ѧ����ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(��) �ݺ�(11)����Ԫ������������Ӧ��ˮ����ֱ�Ϊ�������������ᣬ���Ӧ������������ˮ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O���ʴ�Ϊ��Al(OH)3+3H+=Al3++3H2O��
(��)Ԫ�آ�ĵ��ʺ�Ԫ�آٵ�����������Ӧ��ˮ���ﳣ���·�Ӧ�����������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O���ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�У������(KIO3)��Na2SO3�ɷ������·�Ӧ��2![]() +5
+5![]() +2H+��I2+5
+2H+��I2+5![]() +H2O�����ɵĵ�����õ�����Һ���飬������Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijѧ�����ʵ�����±���ʾ(�����������λ��ΪmL)��
+H2O�����ɵĵ�����õ�����Һ���飬������Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijѧ�����ʵ�����±���ʾ(�����������λ��ΪmL)��
0.01mol/LKIO3��Һ����� | ijŨ�ȵ�Na2SO3��Һ����� | H2O����� | ʵ���¶�/�� | ��Һ������ɫ����ʱ�� | |
ʵ��1 | 5 | 5 | V1 | 0 | a |
ʵ��2 | 5 | 5 | 20 | 25 | b |
ʵ��3 | 5 | V2 | 15 | 25 | c |
(1)V1��______ mL��V2��______ mL��
(2)����о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬ʹ��ʵ��__________��ʵ��__________��
(3)�Ա�ʵ��1��ʵ��2�������о�__________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
(4)��Һ������ɫ�����ʱ��Ӷൽ�ٵ�˳����__________(��a��b��c��ʾ)��
(5)��֪��Ӧ��2Na2SO3(aq)+O2(aq)��2Na2SO4(aq)����291.5Kʱ��1.0 L��Һ��Na2SO3��ʼ��Ϊ10 mmol(1 mol��103 mmol)��ÿ5s��¼һ���ܽ���Ũ�ȣ�һ��ʱ���ʵ���������ߣ���0��40s��Na2SO
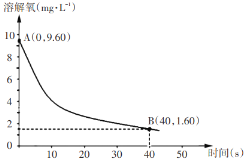
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�����������ں��Ӹֹ죬���һ���������ұ�����۵�Ľ����緰�������̵ȡ�

��1��ijУ��ѧ��ȤС��ͬѧ��ȡ�������������̲��е�ʵ��װ��(��ͼ��)�������ȷ�Ӧ�������׳�ۡ�ָ��ʹ��þ��������ص�Ŀ����___________________��
��2��ijͬѧ��ͼ��װ�ý������ȷ�Ӧ��ȡ��Ӧ��ġ����顱�������ᣬ�����еμ�KSCN��Һ����Һδ����ɫ��Ϊ�ⶨ��ʵ�����á����顱����Ԫ�غ��������ʵ��������ͼ��ʾ��
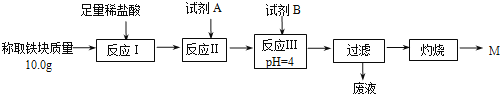
�����������↑ʼ��������ȫ������pH���±���ʾ��
�� �Լ�AӦѡ��________���Լ�BӦѡ��_______(�����)��
A��ϡ���� B�������� C��H2O2��Һ D����ˮ
�� д����Ӧ������ӷ���ʽ____________________________��
�� ��Ƽ�ʵ��֤��M�ijɷ���Fe2O3����Fe3O4__________��

�� ����ʵ��Ӧ������M�������䣬����֤��M��������ı�־��_______��
�� �����պ�ɫ��δM������Ϊ12.0 g����á����顱�Ĵ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ϣ������������ȷ���ǣ� ��
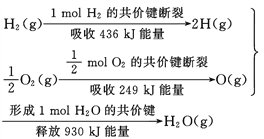
A. 2 mol H2(g)�� 1 mol O2(g)��Ӧ���� 2 mol H2O(g)��������Ϊ490 kJ
B. ��ѧ��Ӧ�������仯�Ĵ�С�뷴Ӧ�������������
C. 1 mol H2(g) ��0.5mol O2(g) ��Ӧ���� 1 mol H2O(l)�ͷ�����Ϊ245 kJ
D. 2molH2O (g)��������2 mol H2(g)��1 mol O2(g)������֮�͵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������Ϊ20.00 mL��Ũ�Ⱦ�Ϊ0.1 mol��L��1��HX��Һ��HY��Һ���ֱ������еμ���ͬŨ�ȵ�NaOH��Һ�������ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
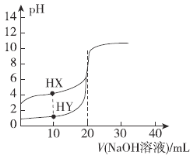
A.�õζ����̵�ָʾ��Ϊ��̪��Һ
B.V��20.00 mLʱ��c(HX)��c(X��)��c(Y��)
C.pH��7ʱ��������Һ��c(X��)��c(Y��)
D.��HX��Һ��ʼpH��3��������HX��Ka��1.0��10��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧƽ�ⳣ��K����ֵ��С�Ǻ�����ѧ��Ӧ���г̶ȵı�־�����з�Ӧ��ƽ�ⳣ����ֵ���£�
2NO��g�� N2��g��+ O2��g�� K1=1��1030
2H2��g��+ O2��g�� 2H2O��g�� K2=2��1081
2CO2��g�� 2CO��g��+ O2��g�� K3=4��10��92
����˵����ȷ���ǣ�������
A. NO�ֽ����O2�ķ�Ӧ��ƽ�ⳣ������ʽK1=c(N2)c(O2)/c(NO)
B. ˮ�ֽ����O2����ʱƽ�ⳣ������ֵԼΪ5��10��80
C. NO��H2O��CO2���ֻ�����ֽ�ų�O2�������ɴ�С��˳��ΪNO��H2O��CO2
D. ����˵��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ______ (��������������������������ȷ����)��Ӧ��
�����д�ʩ������������ԭ��������__________��������ţ�
A������ѹǿ�����ںϳɰ�
B��ʹ�ú��ʵĴ��������ڿ������ɰ�
C����������Ҫ�����¶���500������
D����Ҫʹ�ù�����N2�����H2ת����
��2������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c(NH4+)=c(Cl)����һˮ�ϰ��ĵ���ƽ�ⳣ��Kb��_______________��(��ab��ʾ)
��3��ԭ����H2��ͨ����Ӧ CH4(g) + H2O (g)![]() CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��

��ͼ�У�������������ʾѹǿ�Ĺ�ϵ�ǣ�P1__________P2��������������=��������������
����������һ���������¶ȣ������IJ��ʻ�__________��������������������С��������������
��4��ԭ����H2����ͨ����ӦCO(g) + H2O(g) ![]() CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ��
��T ��ʱ�����ݻ��̶�Ϊ5L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08 mol��L-1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ______________��
�ڱ����¶���ΪT �棬�ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬��_____������ţ���
A��������ѹǿ����ʱ��ı�
B�����������ܶȲ���ʱ��ı�
C����λʱ��������a mol CO2��ͬʱ����a mol H2
D���������n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��Zn��CuΪ�缫��ϡH2SO4Ϊ�������Һ�γ�ԭ��ء�
��H2SO4������ѧ��Ϊ____________��
������0.4mole-�������ߣ��������ϸ�����������____________g��
������ϡ���ỻ������ͭ��Һ���缫�������ӵ���____________(�п������ͭ��������ԭ����____________(�õ缫����ʽ��ʾ����
(2)��T1�¶�ʱ�����ݻ�Ϊ2L�ĺ����ܱ������з�����Ӧ��2NO(g)+O2(g)![]() 2NO2(g)�������и���Ӧ�������������ʵ�����ʱ��仯��ͼ��ʾ���������жϴﵽ��ѧƽ�����____________
2NO2(g)�������и���Ӧ�������������ʵ�����ʱ��仯��ͼ��ʾ���������жϴﵽ��ѧƽ�����____________
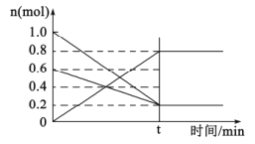
A����Ӧ��NO��O2�����ʵ���֮��Ϊ2��1
B��������������������ʱ��ı仯���仯
C����λʱ����ÿ����2nmolNO2��ͬʱ����nmolO2
D��2v��(O2)=v��(NO)
E����������ѹǿ����
��0~tʱ��Σ���Ӧ����v(NO2)=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӽṹ��Ԫ�������ɵ�֪ʶ�������ƶ���ȷ����(����)
A.ͬ����Ԫ�غ������������˵���������Ӷ�����
B.��������Ų���ͬ������ѧ����Ҳ��ͬ
C.Cl����S2����Ca2����K���뾶��С
D.![]() Cl��
Cl��![]() Cl�õ���������ͬ
Cl�õ���������ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com