
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为______ (填“放热”,“吸热”,“无法确定”)反应。
②下列措施能用勒夏特列原理解释是__________。(填序号)
A.增大压强有利于合成氨
B.使用合适的催化剂有利于快速生成氨
C.生产中需要升高温度至500C左右
D.需要使用过量的N2,提高H2转化率
(2)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl),则一水合氨的电离平衡常数Kb=_______________。(用ab表示)
(3)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线所表示压强的关系是:P1__________P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__________。(填“增大”,“减小”,“不变”)
(4)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,该温度下反应的平衡常数K值为______________。
②保持温度仍为T ℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的_____(填序号)。
A.容器内压强不随时间改变
B.混合气体的密度不随时间改变
C.单位时间内生成a mol CO2的同时消耗a mol H2
D.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6
【答案】放热 A D (b ×10-7)/( a- b) < 增大 2.25 C D
【解析】
(1)①根据平衡常数随温度的变化分析判断;②根据勒夏特列原理,改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,否则勒夏特列原理不适用;
(2)根据电荷守恒结合c(NH4+)=c(Cl-),计算溶液中的氢氧根离子浓度,根据氯离子浓度计算c(NH4+),再利用物料守恒计算溶液中c(NH3·H2O),最后计算NH3H2O的电离常数;
(3)依据图象采用定一议二的方法分析解答;
(4)①依据化学平衡三段式列式计算;②根据化学平衡状态的特征分析判断。
(1)①图表中平衡常数随温度升高减小,说明升高温度,平衡逆向进行,逆向是吸热反应,正向是放热反应,故答案为:放热;
②A.增大压强,合成氨反应向着气体的系数和减小的方向进行,有利于合成氨,可以用平衡移动原理解释,故A正确;B.使用合适的催化剂只能加快反应速率,但是不会引起平衡的移动,不可以用平衡移动原理解释,故B错误;C.合成氨反应是放热的,升高温度,反应逆向移动,生产中需要升高温度至500°C左右是为了加快反应速率,提高催化活性,不可以用平衡移动原理解释,故C错误;D.使用过量的N2,合成氨反应正向移动,可以提高H2转化率,可以用平衡移动原理解释,故D正确;故选AD;
(2)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,根据电荷守恒c(NH4+)+ c(H+)=c(Cl-)+ c(OH-),溶液中c(NH4+)=c(Cl-),故溶液中c(H+)=c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=bmolL-1,故混合后溶液中c(NH3·H2O)=amolL-1-bmolL-1=(a-b)mol/L,NH3H2O的电离常数Kb= ![]() ,故答案为:
,故答案为:![]() ;
;
(3)①依据图象变化,相同温度下,CH4(g)+H2O (g)CO(g)+3H2(g),反应是气体体积增大的反应,增大压强,平衡逆向进行,甲烷平衡含量增大,所以P1<P2,故答案为:<;
②压强一定,升高温度,甲烷平衡含量减小,说明平衡正向移动,正反应为吸热反应,因此,其它条件一定,升高温度,平衡正向移动,氢气的产率会增大,故答案为:增大;
(4)①依据化学平衡三段式列式计算平衡浓度,℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL-1,
CO(g)+H2O(g)CO2 (g)+H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.08 0.12 0.12
则该温度下反应的平衡常数K=![]() =2.25,故答案为:2.25;
=2.25,故答案为:2.25;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CO(g)+H2O(g)═CO2 (g)+H2(g),反应是气体体积不变反应。A.反应过程中和平衡状态下压强相同,容器内压强不随时间改变,不能说明反应达到平衡状态,故A不符合;B.混合气体质量守恒,反应前后气体体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故B不符合;
C.单位时间内生成amolCO2的同时消耗amolH2,说明二氧化碳或氢气的正逆反应速率相同,说明反应达到平衡状态,故C符合;D.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6,依据反应前后气体物质的量相同,可以利用物质的量代替浓度计算浓度商和平衡常数比较,Qc=![]() =2.25=K,说明反应达到平衡状态,故D符合;故答案为:CD。
=2.25=K,说明反应达到平衡状态,故D符合;故答案为:CD。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是( )
2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,按要求回答下列问题。
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | (11) | ⑧ | ⑩ | ||||
三 | ① | ③ | ⑤ | ⑦ | (12) | ⑨ | ||
四 | ② | ④ |
(1)在这12种元素中,化学性质最不活泼的元素名称是______,得电子能力最强的原子是_____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是_____(写化学式)。
(2)
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ______。
(4)请写出:
(ⅰ) ③的单质置换出⑥的单质的化学方程式:_________________________。
(ⅱ) ⑤和(11)两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________。
(ⅲ)元素⑨的单质和元素①的最高价氧化物对应的水化物常温下反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
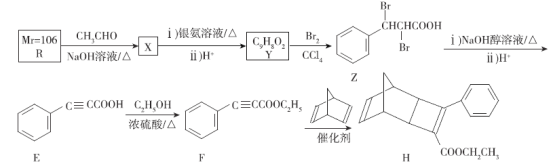
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测定含有少量氯化钠的碳酸氢钠的含量,完成下列填空:
方案1:取样品溶解后,加试剂使HCO3-沉淀,测定沉淀的质量。
操作步骤有:①称量并溶解样品;②加入足量的Ba(OH)2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。
(1)实验时所需的定量实验仪器为___,判断是否达到恒重的标准是__。
方案2:用0.100mol/L盐酸滴定。具体过程如图:
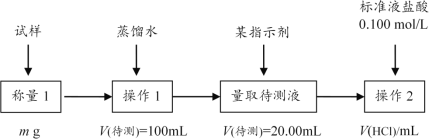
(2)操作1所需要的仪器有__。
(3)操作2时选择的指示剂为甲基橙,当溶液___时,说明达到了操作2终点。为减少实验的偶然误差,通常的处理办法是__。
(4)操作2时若锥形瓶内有少量液体溅出,则测定结果__;若盛装待测液的锥形瓶未用待测液润洗,测定结果___。(选填“偏高”、“偏低”或“无影响”)
(5)用图中的数据,计算小苏打中碳酸氢钠的质量分数___。
方案3:用稀盐酸将HCO3-转化为CO2,测定CO2的体积。
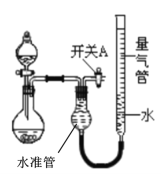
(6)为保证读数的准确性并易于观察,实验中量气管中的液体最好是__(填字母编号)。
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液 c.含有品红的硫酸溶液
本实验应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,
②___,
③视线与凹液面最低处相平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
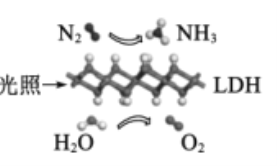
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的结构简式如图所示。下列有关化合物X的说法正确的是
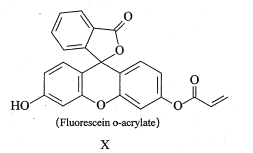
A.分子中3个苯环处于同一平面
B.分子中只有1个手性碳原子
C.1molX最多能与lmolBr2反应
D.1molX 与NaOH溶液反应时最多消耗4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )

A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com