
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)��������������̣�

����˵������ȷ���ǣ� ��
A. �ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B. ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl(OH)3���������2
C. ����Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D. ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
���𰸡�D
��������
A�����������ͼ���������Fe2O3��Al2O3��ת��Ϊ�����Σ���ȥSiO2��Ȼ�������ۻ�ԭFe3+�õ�����������A��ȷ��B������1ΪSiO2������FeSO4��Al2(SO4)3���õ��ǵ���pH�ķ�����ʹAl3+ת��ΪAl(OH)3�����Ӷ���FeSO4���룬B����ȷ��C��Fe2+���ױ������������ڵõ�FeSO4��7H2O��Ʒ�Ĺ����У�Ҫ��ֹ�䱻�����ͷֽ⣬C��ȷ��D������Һ1��ֱ�Ӽӹ�����NaOH�õ�����Fe(OH)2��������Fe(OH)2���ȶ��������ױ�����ΪFe(OH)3�������Ļ����������õIJ�Ʒ���������н϶������Fe2(SO4)3��D����ȷ����ѡD��


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
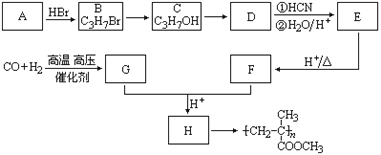
����Ŀ��A��D�������г����Ľ������ʣ�B��C��E��F��G��H����ѧ������6�ֻ������Ӧ�ٿ����ں��Ӹֹ죬������ʼ�Ĺ�ϵ����ͼ��ʾ��

(1)H�Ļ�ѧʽ��______________��
(2)��Ӧ�ٵĻ�ѧ����ʽ��____________________________��
(3)��Ӧ�ڵ����ӷ���ʽ��____________________________��
(4)����F��Һ�н��������ӵIJ�����������____________________________��
(5)Hת��ΪG��ʵ��������__________________________________________��
(6)Ϊ�˸�����ع۲쵽����H������ʹF����Һ��NaOH��Һ��Ӧ����ȷ������_______(����ͼ��ĸ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ũҵ�о�����־�����������Ŀ�ѧ�ҷ��ְ��װ�������ǿ���̲�����Ⱦ�ߵ����������Կ��ư��̲�������������Ч����֪���װ���Ľṹ��ʽΪ![]() ��������˵��������ǣ�������
��������˵��������ǣ�������
A. �����Ӱ��װ�����ˮ�γɵĶ��Ľṹ��ʽΪ��![]()
B. ���װ�����һ����������
C. ![]() �������NaOH��Һ��Ӧ�ų�����
�������NaOH��Һ��Ӧ�ų�����
D. ��Ȼ������ˮ������Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ���л������ɰ�����·�ߺϳɣ�
���л������ɰ�����·�ߺϳɣ�
�����
��1��A��E�Ľṹ��ʽ�ֱ�Ϊ��___________________��______________________��
��2��B��C��E��F�ķ�Ӧ���ͷֱ�Ϊ��________________��________________��
��3��д������ת���Ļ�ѧ����ʽ��C��D___________________________________________��G+F��H___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ��д�����Mg2����Al3����H����Cl��������OH���������Һ����μ���0.5 mol��L��1NaOH��Һ�����ɳ����������ͼ���NaOH��Һ�����֮��Ĺ�ϵ����ͼ��ʾ������ж�ԭ��Һ��(����)
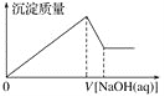
A. ��Mg2����û��Al3��
B. ��Al3����û��Mg2��
C. ��Mg2����Al3��
D. �����H����Mg2����Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ����
A. 3-��-2-�һ�����B. 2-�һ�-1-��ϩ
C. 3, 4, 4-��������D. 2-��-3-��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������������̽��SO2�����ʡ�ʵ��ʱ��Na2SO3�����ϵμ���Ũ���ᣬ��������һ������������档
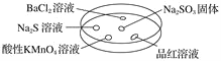
�±��ж�ʵ������������������Ľ��Ͳ���ȷ����(����)
ѡ�� | ʵ������ | ���� |
A | BaCl2��Һ����� | SO2��BaCl2��Һ��Ӧ������BaSO3���� |
B | Na2S��Һ����� | SO2��Na2S��Һ��Ӧ������S���� |
C | ����KMnO4��Һ��ɫ | SO2���л�ԭ�� |
D | Ʒ����Һ��ɫ | SO2����Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵ�ذ���ϳ��������⣬����ͭ�������������Ȼ�ѧ���ʡ�
��1����̬ͭԭ����________���˶�״̬��ͬ�ĵ��ӣ��������ռ������ܲ�ķ�����__________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ____________________��
��2�����������������Ԫ���γ���̬�⻯��������γɵ��������⻯��ķ��ӹ��ͷֱ�Ϊ______________��_______________��
������Si��H���й��õ��Ӷ�ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪ Se___Si���>����<������
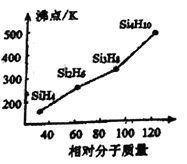
�����ǰѹ�����Ԫ���γɵ�һ�����й��顣�������ɡ��ṹ����Ӧ���������ƣ�����ķе�����Է��������Ĺ�ϵ��ͼ��ʾ���������ֱ仯��ԭ����________________________________________��
����������Ԫ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3��NH3��BF3��NH3��Bԭ�ӵ��ӻ��������Ϊ________________��B��N֮���γ�_________����
��4���黯��Ϊ�������뵼�壬����Ϊ��������ĵ����������������١�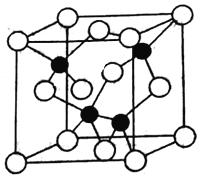
��֪�黯�صľ����ṹ��ͼ��ʾ�����黯�صĻ�ѧʽΪ____________��AS��Ga֮��Ļ�ѧ��Ϊ________��_________���黯���ܶ�Ϊ��g��cm-3�� Ga��As��Ħ�������ֱ�ΪMGa g��mol-1��MAs g��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAspm�������ӵ�����ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ______________���ú��Цѡ�NA�ȷ��ŵ�ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ�п��Դ��������һ���ǣ���
A. H+ Na+ OH�� B. Na+ NO3�� Cl��
C. K+ H+ HCO3�� D. Ca2+ SO42�� CO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com