
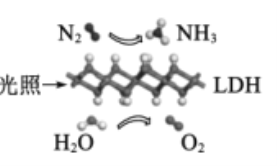
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
【答案】C
【解析】
从原理图中可以看出,N2与H2O在光照条件下,在催化剂表面发生反应,转化为NH3和O2,发生反应的化学方程式为2N2+6H2O![]() 4NH3+3O2。
4NH3+3O2。
A.在光照条件下,N2与H2O在催化剂LDH表面发生化学反应生成NH3和O2,将太阳能转化成为化学能,A正确;
B.从反应2N2+6H2O![]() 4NH3+3O2中可以得出,氧化剂(N2)与还原剂(H2O)的物质的量之比为2:6=1:3,B正确;
4NH3+3O2中可以得出,氧化剂(N2)与还原剂(H2O)的物质的量之比为2:6=1:3,B正确;
C.该过程中,没有离子化合物参与反应,也没有离子化合物生成,所以不涉及离子键的断裂与生成,C不正确;
D.空气中含有大量的N2,可将空气液化,然后蒸馏,从而获得原料气N2,D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】根据国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》指出,冠状病毒对紫外线和热敏感,含氯消毒剂过氧乙酸等脂溶剂均可有效灭活病毒,但氯已定不能有效灭活病毒。氯已定又名洗必泰,化学名为双氯苯双胍已烷,系阳离子表面活性剂,具有相当强的广谱抑菌、杀毒作用,其结构如图所示。下列关于氯己定的说法中正确的是
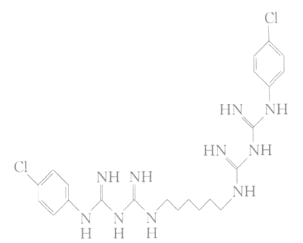
A.其分子式为C22H30Cl2N10
B.其苯环上的一溴代物有四种
C.一定条件下,氯已定最多可与6mol氢气加成
D.一定条件下,氯已定可发生加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积均为20.00 mL、浓度均为0.1 mol·L-1的HX溶液和HY溶液,分别向其中滴加相同浓度的NaOH溶液,混合溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是
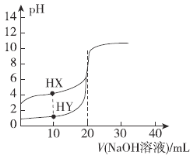
A.该滴定过程的指示剂为酚酞溶液
B.V=20.00 mL时,c(HX)+c(X-)=c(Y-)
C.pH=7时,两种溶液中c(X-)=c(Y-)
D.若HX溶液起始pH=3,则常温下HX的Ka≈1.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为______ (填“放热”,“吸热”,“无法确定”)反应。
②下列措施能用勒夏特列原理解释是__________。(填序号)
A.增大压强有利于合成氨
B.使用合适的催化剂有利于快速生成氨
C.生产中需要升高温度至500C左右
D.需要使用过量的N2,提高H2转化率
(2)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl),则一水合氨的电离平衡常数Kb=_______________。(用ab表示)
(3)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线所表示压强的关系是:P1__________P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__________。(填“增大”,“减小”,“不变”)
(4)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,该温度下反应的平衡常数K值为______________。
②保持温度仍为T ℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的_____(填序号)。
A.容器内压强不随时间改变
B.混合气体的密度不随时间改变
C.单位时间内生成a mol CO2的同时消耗a mol H2
D.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用SiC与Cl2反应(SiC+2Cl2![]() SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
A. 制取氯气
制取氯气
B. 净化氯气,气体从接口①进入
净化氯气,气体从接口①进入
C. 制取四氯化硅
制取四氯化硅
D. 收集四氯化硅粗产品
收集四氯化硅粗产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成原电池。
①H2SO4所含化学键为____________;
②若有0.4mole-流过导线,则理论上负极质量减少____________g;
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是____________(填“锌极”或“铜极”),原因是____________(用电极方程式表示);
(2)①T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
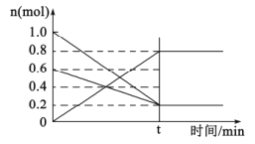
A.反应中NO与O2的物质的量之比为2:1
B.混合气体的总质量不随时间的变化而变化
C.单位时间内每消耗2nmolNO2,同时生成nmolO2
D.2v正(O2)=v逆(NO)
E.混合气体的压强不变
②0~t时间段,反应速率v(NO2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量质量增加了0.1mol,则反应速率为
A. v(NH3)=0.02mol/(L·min)
B. v(NH3)=0.01mol/(L·min)
C. v(N2)=0.01mol/(L·min)
D. v(H2)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种钢闸门保护法原理示意图如下,下列说法不正确的是
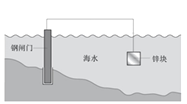
A. 锌块发生氧化反应:Zn-2e–= Zn2+
B. 钢闸门有电子流入,可以有效减缓腐蚀
C. 若通过外加电源保护钢闸门,应将钢闸门与电源正极相连
D. 锅炉内壁装上若干镁合金的防腐原理与该种钢闸门保护法原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com