
【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
【答案】c 偏大 锥形瓶中溶液颜色变为浅红色,且半分钟不褪色 0. 1100
【解析】
(1)a. 量筒无法达到题中要求的精确度,a错误;
b. 容量瓶是用来配制溶液的仪器,不是量取用的仪器,b错误;
c. c为酸式滴定管,用来量取酸性溶液,c正确;
d. d为碱式滴定管,用来量取碱性溶液,d错误;
故合理选项为c;
(2)若碱式滴定管未经过润洗,则相当于将NaOH溶液进行了稀释,即c(NaOH)偏小,则消耗的NaOH溶液的体积偏大,在计算中,c(NaOH)仍是原先的浓度,c(白醋)的计算结果将偏大;
(3)由于题中的操作是将碱液滴入含酚酞的酸液中,所以滴定终点的现象为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)3次实验平均消耗NaOH溶液的体积为22.00mL,所以该白醋的总酸度为:![]() =0.1100mol·L-1。
=0.1100mol·L-1。


科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
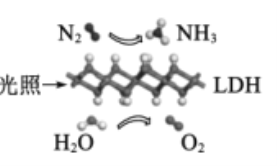
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
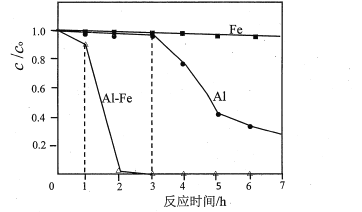
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )

A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1)某蓄电池反应为2NiO(OH)+Cd+2H2O![]() Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
(2)镍的羰化反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH。
Ni(CO)4(g) ΔH。
①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=__mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH__0(填“>”或“<")。
(3)NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下:
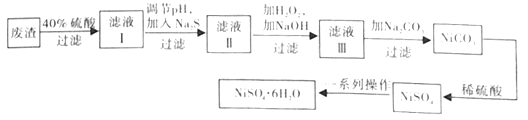
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有__。
②向滤液Ⅰ中加入Na2S的目的是_。(已知:Ksp[FeS]=6.3×10-18,Ksp[CuS]=1.3×10-36,Ksp[ZnS]=1.3×10-24,Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有__。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为__。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是__(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
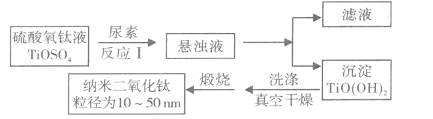
回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:
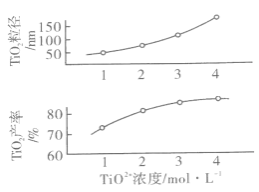
结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
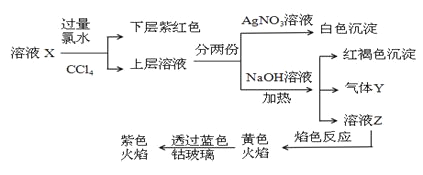
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com