
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
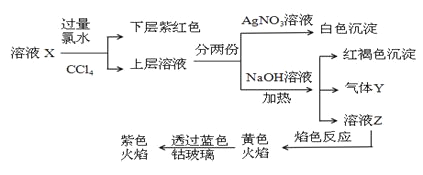
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
【答案】C
【解析】
由于加入过量的氯水和四氯化碳后,下层呈紫红色,所以原溶液中含有碘离子,上层溶液加氢氧化钠溶液产生红褐色沉淀,说明加入氯水后溶液中存在铁离子,又因铁离子氧化性大于碘单质,因此原溶液中存在亚铁离子而不存在铁离子,根据离子共存可知原溶液不存在碳酸根离子,产生气体说明原溶液中含有铵离子,所得溶液进行焰色反应实验透过蓝色钴玻璃观察到紫色火焰,因此原溶液中含有钾离子,又因溶液中各离子浓度相同,根据电荷守恒分析可知原溶液中存在硫酸根离子和氯离子,故原溶液中一定含有硫酸根、碘离子、亚铁离子和钾离子、铵离子和氯离子。
A.根据上述分析可知原溶液中不存在铁离子,A项错误;
B.根据上述分析可知原溶液中不存在钠离子,B项错误;
C.根据上述分析可知该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的,C项正确;
D.由于原溶液中存在有硫酸根,加入氯化钡后只产生硫酸钡沉淀,不溶于盐酸,D项错误。
故答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
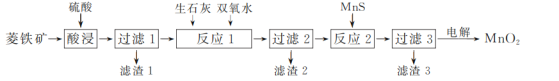
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种含酰亚胺结构的对苯二胺衍生物的合成路线,其产物(F)可作为一种空腔孔径较大的新型大环芳酰胺的合成原料。
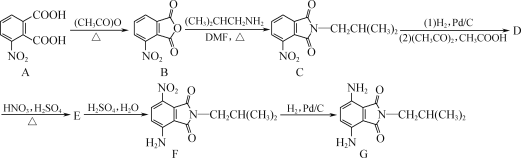
(1)A中官能团的名称为________和________。
(2)F→G的反应类型为________。
(3)D的分子式为C14H16N2O3,写出D的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②含有苯环,且苯环上含有硝基;
③含有三种不同化学环境的氢原子。
(5)写出以甲苯、邻二甲苯,制备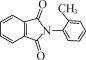 (无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
(无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
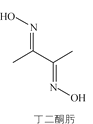
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
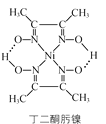
a.配位键 b. 离子键 c. 氢键 d. 范德华力
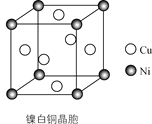
(4)某镍白铜的晶胞如图所示,其化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O
C.向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔH>0,ΔS<0
B.常温下,将稀CH3COOH溶液加水稀释,溶液中![]() 的值不变
的值不变
C.在铜的精炼过程中,若转移1mol电子,则阴极析出Cu的质量为32g
D.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则其热化学方程式为N2(g)+3H2(g)=2NH3(g);ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银系列产品广泛地应用于化工、电子电锁、材料和工业催化等领域,对含银废料中贵金属银的综合回收具有重要的研究意义。一种对银粉和 AgNO3 生产过程中产生的含银废料进行综合回收的工艺流程如图:
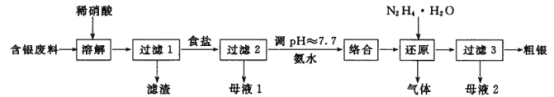
回答下列问题:
(1)“溶解”反应的化学方程式为 ______。稀硝酸能否用浓硫酸代替____(填“能”或“不能”),原因是______________。
(2)“过滤3”操作中用到的玻璃仪器是_____________。
(3)“络合”步骤中需要加氨水调pH≈7.7,生成的络合物为_____________。
(4)N2H4H2O称水合肼,具有强还原性和碱性。水合肼与硫酸反应生成正盐的化学式为_______。
(5)“还原”步骤中产生的气体可参与大气循环,该气体分子的电子式为_______。
(6)“母液 2”中溶质的化学式为______________。
(7)粗银经过烘干、焙烧、电解得到纯度99. 9% 的银。
①焙烧是在中频炉中进行 ,中频炉优点是加热升温速度快,氧化烧损仅为 0.5%, 在此焙烧目的是_______。
②电解时粗银做电极阳极,阴极为不锈钢板 ,电解液为 AgNO3 、HNO3 、KNO3 混合溶液,电解液中HNO3 和 KNO3 的作用分别是__________、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com