
【题目】银系列产品广泛地应用于化工、电子电锁、材料和工业催化等领域,对含银废料中贵金属银的综合回收具有重要的研究意义。一种对银粉和 AgNO3 生产过程中产生的含银废料进行综合回收的工艺流程如图:
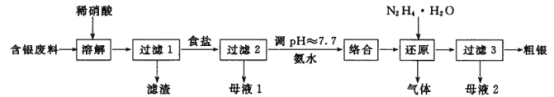
回答下列问题:
(1)“溶解”反应的化学方程式为 ______。稀硝酸能否用浓硫酸代替____(填“能”或“不能”),原因是______________。
(2)“过滤3”操作中用到的玻璃仪器是_____________。
(3)“络合”步骤中需要加氨水调pH≈7.7,生成的络合物为_____________。
(4)N2H4H2O称水合肼,具有强还原性和碱性。水合肼与硫酸反应生成正盐的化学式为_______。
(5)“还原”步骤中产生的气体可参与大气循环,该气体分子的电子式为_______。
(6)“母液 2”中溶质的化学式为______________。
(7)粗银经过烘干、焙烧、电解得到纯度99. 9% 的银。
①焙烧是在中频炉中进行 ,中频炉优点是加热升温速度快,氧化烧损仅为 0.5%, 在此焙烧目的是_______。
②电解时粗银做电极阳极,阴极为不锈钢板 ,电解液为 AgNO3 、HNO3 、KNO3 混合溶液,电解液中HNO3 和 KNO3 的作用分别是__________、_________。
【答案】3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O 不能 硫酸银覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去 烧杯、玻璃棒、漏斗 Ag(NH3)2Cl N2H6SO4 ![]() NH4Cl 除去粗银中含有的杂质 调节电解液的pH 提高电解液的导电性
NH4Cl 除去粗银中含有的杂质 调节电解液的pH 提高电解液的导电性
【解析】
(1)“溶解”反应是银与稀硝酸反应生成硝酸银、NO和水;不能浓硫酸代替稀硝酸,因为硫酸银微溶;
(2)根据过滤操作作答;
(3)过滤2的固体为AgCl,加入氨水,生成Ag(NH3)2Cl;
(4)N2H4H2O具有碱性,与硫酸反应生成N2H6SO4;
(5)利用电子守恒、原子守恒结合题意,写出反应的化学方程式;
(6)根据(5)作答;
(7)①反应中有物质包裹,焙烧可除去;
②HNO3显酸性,可调节电解液的pH;KNO3 可提高电解液的导电性。
(1)“溶解”反应是银与稀硝酸反应生成硝酸银、NO和水,方程式为:3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O;不能浓硫酸代替稀硝酸,因为硫酸银微溶,覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去,故答案为:3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O;不能;硫酸银覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去;
(2)过滤操作要用的玻璃仪器有:烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(3)过滤2的固体为AgCl,加入氨水,发生络合反应生成Ag(NH3)2Cl,故答案为:Ag(NH3)2Cl;
(4)N2H4H2O具有碱性,与硫酸反应生成正盐为N2H6SO4,故答案为:N2H6SO4;
(5)水合肼具有还原性,其被Ag(NH3)2Cl氧化的方程式为N2H4·H2O+4Ag(NH3)2Cl=N2↑+4Ag↓+H2O+ 4NH4Cl,则产生的气体N2可参与大气循环,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)根据(5)可知,反应后溶液中存在NH4Cl,“母液2”中溶质的化学式为NH4Cl,故答案为:NH4Cl;
(7)①过滤后NH4Cl包裹在粗银中,焙烧可除去,故答案为:除去粗银中含有的杂质;
②HNO3显酸性,可调节电解液的pH;KNO3 可提高电解液的导电性,故答案为:调节电解液的pH;提高电解液的导电性。


科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
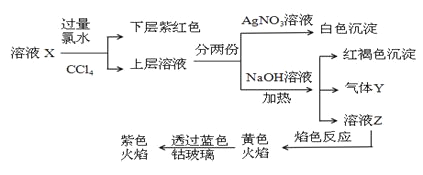
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,其代表为铜催化的Huisgen环加成反应:![]()
我国化学研究者利用该反应设计、合成了具有特殊结构的聚合物G并研究其水解反应。合成线路如图:
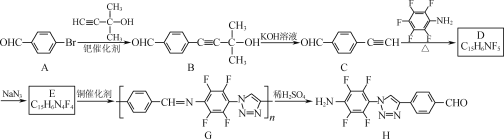
已知:![]() +H2O。
+H2O。
(1)B分子中的含氧官能团为___、___(填名称)。
(2)A→B的反应类型为___。
(3)D的结构简式为___。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__。
①分子中除苯环外,不含其他环状结构;②能发生银镜反应和水解反应;③分子中有4种不同化学环境的氢原子。
(5)写出以![]() 、HC
、HC![]() CCH3和CH3Br为原料制备
CCH3和CH3Br为原料制备![]() 的合成路线流程图__(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图__(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(l)基态铁原子的价电子轨道表达式(电子排布图)为____________________________;在基态Ti2+中,电子占据的最高能层具有的原子轨道数为____________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+___Fe3+(填“大于”或“小于”),原因是___________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)______________。
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为___________。
A.  B.
B.  C.
C.  D.
D. 
(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
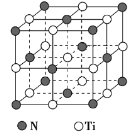
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为__________;
Ti原子与跟它次邻近的N原子之间的距离为____________。
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为____________。(用a、b表示)
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A. 碳与热的浓硫酸反应的化学方程式:C+2H2SO4(浓)![]() CO↑+2SO2↑+2H2O
CO↑+2SO2↑+2H2O
B. 乙炔燃烧的化学方程式:2C2H2 +5O2 ![]() 4CO2 +2H2O
4CO2 +2H2O
C. 氯化氢在水中的电离方程式:HCl=H+ +Cl-
D. 氯化铵水解的离子方程式:NH4++H2O ![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子得到的电子数目等于碳原子失去的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%-5%的D,其转化关系如下图所示。
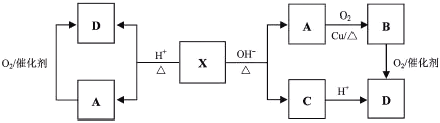
请回答:
(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)下列说法不正确的是________。
A.A+D→X的反应属于取代反应
B.除去X中少量D杂质可用饱和Na2CO3溶液
C.A与金属钠反应比水与金属钠反应要剧烈得多
D.等物质的量的A、B、D完全燃烧消耗O2的量依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
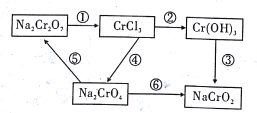
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
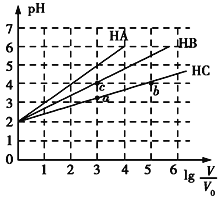
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com