
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
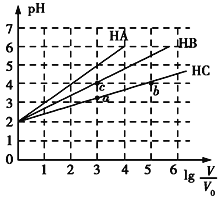
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
【答案】D
【解析】
根据图知,pH=2的HA、HB、HC溶液分别稀释100倍,HA的pH变成4,说明HA是强酸,HB、HC的pH增大小于2,则HB、HC为弱酸,且HB的pH增大幅度大于HC,说明HB的酸性>HC,因此酸性HA>HB>HC,据此分析解答。
A.酸性HB>HC,则Ka(HB)>Ka(HC),故A正确;
B.溶液的浓度越小,弱酸的电离程度越大,因此HC的电离度:a点<b点,故B正确;
C.当lg![]() =4,即稀释10000倍时,三种溶液同时升高温度,常见弱电解质的电离程度增大,而HA为强酸,电离程度不变,因此
=4,即稀释10000倍时,三种溶液同时升高温度,常见弱电解质的电离程度增大,而HA为强酸,电离程度不变,因此![]() 减小,故C正确;
减小,故C正确;
D.当lg![]() =5时,HA电离出的c(H+)=10-7 mol/L,此时,不能忽略水的电离,溶液中c(H+)略大于10-7 mol/L,pH略小于7,仍显酸性,故D错误;
=5时,HA电离出的c(H+)=10-7 mol/L,此时,不能忽略水的电离,溶液中c(H+)略大于10-7 mol/L,pH略小于7,仍显酸性,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下图转化关系(部分反应物、产物及反应条件已略去)。请回答:
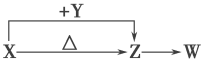
(1)Y的电子式是____________________。
(2)X与Y在溶液中反应的离子方程式是__________________________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
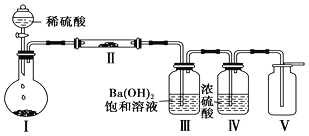
①装置Ⅰ中反应的化学方程式是_________________________________________________,装置Ⅱ中反应的化学方程式是________________________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是___________,所需仪器装置是_______________。 (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
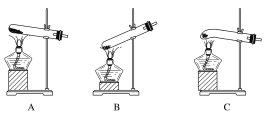
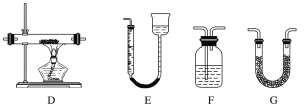
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
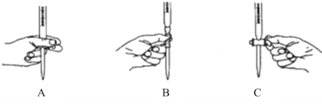
③判断反应达到滴定终点时的现象为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) ![]() 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:

①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________mol/(L·s)。
②ΔH________0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______;
②T℃ 时该反应的平衡常数为________。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验硫酸根离子的存在时,先在待测溶液中加入盐酸,其作用是
A. 形成较多的白色沉淀
B. 形成的沉淀纯度更高
C. 排除硫酸根离子以外其他阴离子及银离子的干扰
D. 排除钡离子以外的其他阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的下列说法正确的是![]()
![]()
A. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
B. 油脂在碱性条件下的水解反应称为皂化反应,反应生成甘油和高级脂肪酸
C. 淀粉与纤维素通式相同,但二者不互为同分异构体
D. 鉴定蔗糖水解产物中的葡萄糖:在水解液中直接加入银氨溶液并水浴加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com