
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
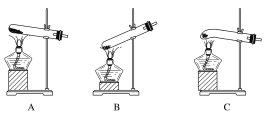
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
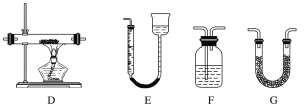
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
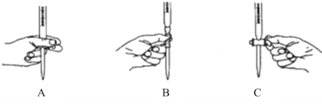
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
③判断反应达到滴定终点时的现象为__________________________________________。
【答案】固体药品熔化后会流到试管口,不利于草酸晶体分解 冷凝水会倒流到试管底,造成试管炸裂 澄清的石灰水 前一个F中没有浑浊现象出现,D中固体颜色由黑色变为红色,后一个F中有浑浊现象出现 2MnO4-+ 5H2C2O4 + 6H+= 2Mn2++ 10CO2↑+ 8H2O A 当滴入最后一滴标准液时,溶液由无色变为紫红色且30s不褪色
【解析】
(1)草酸晶体的熔点低,受热容易熔化,用C装置加热分解革酸晶体,熔融的固体不易流下,适用于加热草酸,若选择装置A加热会使固体熔融物溶化后流到试管口处,若选择装置B分解生成的水会倒流试管底部炸裂试管;
(2)实验利用装置“G(碱石灰)-F-D(CuO固体)-F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体;
(3)①高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开;
③可利用高锰酸钾溶液自身的颜色作为指示剂判断滴定终点。
(1)最适宜加热分解革酸晶体的装置是C,若选装置A可能会造成的后果是固体药品熔化后会流到试管口,不利于草酸晶体分解;若选装置B可能会造成的后果是冷凝水会倒流到试管底,造成试管破裂,
故答案为:固体药品熔化后会流到试管口,不利于草酸晶体分解;冷凝水会倒流到试管底,造成试管破裂。
(2)实验利用装置“G(碱石灰)-F-D(CuO固体)-F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体,
故答案为:澄清的石灰水;前一个F中没有浑浊现象出现,D中固体颜色由黑色变为红色,后一个F中有浑浊现象出现。
(3)①高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
②根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作,故答案为:A。
③可利用高锰酸钾溶液自身的颜色作为指示剂判断滴定终点,当滴入最后一滴标准液时,溶液由无色变为紫红色且30s不褪色,故答案为:当滴入最后一滴标准液时,溶液由无色变为紫红色且30s不褪色。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是
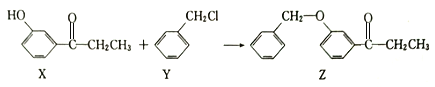
A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是

A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y=2Z,如图所示是该反应中X的物质的量随时间变化的曲线。

(1)2 min内的平均速率是________;
(2)4 min内的平均速率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
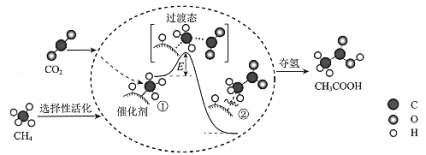
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. 该催化剂可有效提高反应物的平衡转化率
C. ①→②放出能量并形成了C-C键
D. CH4→CH3COOH过程中,有C-H键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
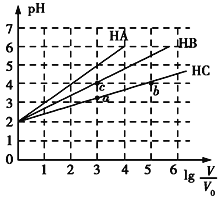
A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去氯化钠中少量的氯化钙、硫酸钠杂质,下列选用的试剂及加入顺序正确的是
A. Na2CO3、BaCl2、HCl B. BaCl2、Na2CO3、H2SO4
C. BaCl2、Na2CO3、HCl D. Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液在如下图所示的装置中 进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
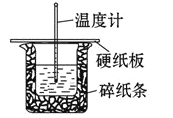
(1)从实验装置上看,图中缺少的一种玻璃仪器是_____。
(2)烧杯间填满碎纸条的作用是_____。
(3)若大烧杯上不盖硬纸板,求得的反应热数值______填“偏大”“偏小”或“无影响”)。
(4)若取取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液的密度都是 1 g/cm3,中和后生成溶液 的比热容 c=4.18 J/(g·℃)。则中和热△H=_____(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:

(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com