
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
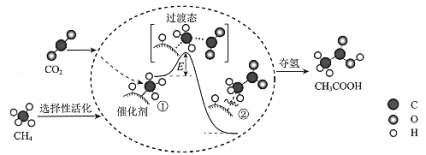
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. 该催化剂可有效提高反应物的平衡转化率
C. ①→②放出能量并形成了C-C键
D. CH4→CH3COOH过程中,有C-H键发生断裂
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )
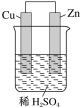
①铜为阳极,锌为阴极;②铜极上有气泡;③SO![]() 向铜极移动;④若有0.5mol电子流经导线,则可产生5.6L气体;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-===Zn2+
向铜极移动;④若有0.5mol电子流经导线,则可产生5.6L气体;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-===Zn2+
A. ①② B. ①④⑥ C. ②④⑥ D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的溶液,下列操作中正确的是( )
A. 称量时,应先在两盘上放等质量的纸,再将固体NaOH放在天平左盘上称量
B. 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C. 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D. 定容时如果加水超过了刻度线,用胶头滴管再吸出多余部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入气体X和气体Y反应生成气体Z,从反应开始到建立化学平衡,用X、Y、Z分别表示的化学反应速率为v(X)、v(Y)、v(Z)有以下关系:v(X)=3v(Y)、2v(Y)=v(Z),则此反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
①1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中,![]() 的数量为0.1 NA
的数量为0.1 NA
②0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
③标准状况下,22.4 L二氯甲烷的共价键数为7NA个
④一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2 NA
⑤31g白磷P4中含P—P单键数目为6NA
⑥2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目小于0.001 NA
A. ①④⑥ B. ②④⑥ C. ②④⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
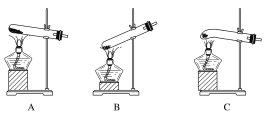
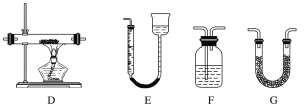
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
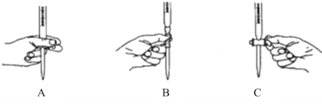
③判断反应达到滴定终点时的现象为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
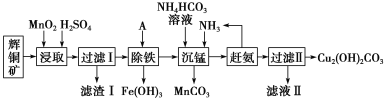
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com