
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
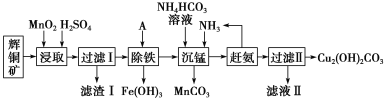
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
【答案】MnO2 S SiO2 CuO 或 Cu(OH)2 或CuCO3或Cu2(OH)2CO3 4.0×10-8 Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O (NH4)2SO4 取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
(1)由滤渣1的成份可知反应的化学方程式是:
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
(2)根据Ksp[Fe(OH)3]=c(Fe3+)[c(OH-)]3=4.0×10-38,根据OH-离子的浓度计算Fe3+离子的浓度;
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
(5)根据硫酸根离子的检验方法进行分析。
(1)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,故答案为:MnO2,S、SiO2。
(2)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,因最后要制备碱式碳酸铜,则可加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等,若加入A后溶液的pH值为4,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38,则溶液中铁离子浓度:4.0×10-38/(10-10)3mol/L=4.0×10-8mol/L,故答案为:4.0×10-8。
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O,故答案为:Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O。
(4)滤液Ⅱ主要是硫酸铵溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4。
(5)分析流程题可知,第一步加入了H2SO4,在整个过程中没有除去H2SO4,判断沉淀是否已经洗净,就是检验是否含有SO42-,检验方法为:取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,故答案为:取少量最后一次洗涤液于试管中,加入足量稀HCl酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
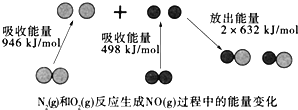
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
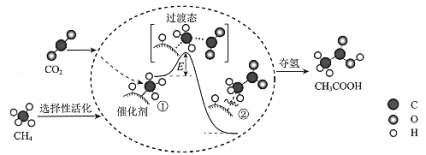
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. 该催化剂可有效提高反应物的平衡转化率
C. ①→②放出能量并形成了C-C键
D. CH4→CH3COOH过程中,有C-H键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去氯化钠中少量的氯化钙、硫酸钠杂质,下列选用的试剂及加入顺序正确的是
A. Na2CO3、BaCl2、HCl B. BaCl2、Na2CO3、H2SO4
C. BaCl2、Na2CO3、HCl D. Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,其放电时的原电池反应:![]() 根据此反应判断,下列叙述中正确的是
根据此反应判断,下列叙述中正确的是![]()
![]()
A. Pb是正极
B. ![]() 得电子,被氧化
得电子,被氧化
C. 电池放电时,溶液的酸性增强
D. 负极反应是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.请回答:(不要求写计算过程)
(1)写出铜与稀硝酸反应的化学方程式________________。
(2)NO为_________ mol.标准状况V(NO):V(NO2)=________
(3)原硝酸溶液的浓度为__________ molL-1 。
(4)试描述实验过程中试管内产生气体现象___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com