
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液在如下图所示的装置中 进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
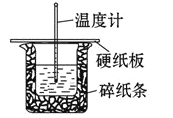
(1)从实验装置上看,图中缺少的一种玻璃仪器是_____。
(2)烧杯间填满碎纸条的作用是_____。
(3)若大烧杯上不盖硬纸板,求得的反应热数值______填“偏大”“偏小”或“无影响”)。
(4)若取取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液的密度都是 1 g/cm3,中和后生成溶液 的比热容 c=4.18 J/(g·℃)。则中和热△H=_____(取小数点后一位)。
【答案】环形玻璃搅拌棒减少实验过程中的热量损失偏小-53.5 kJ/mol
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)不盖硬纸板,会有一部分热量散失;
(4)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m·c·△T计算反应放出的热量,然后根据△H=-Q/nkJ·mol-1计算出反应热.
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,偏小;
(4)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组舍去,温度差平均值=(4.0℃+3.9℃+4.1℃)/3=4.0℃;②50mL0.50mol·L-1氢氧化钠与30mL0.50mol·L-1硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol·L-1=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m·c·△T=80g×4.18J/(g·℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-1.3376kJ/0.025mol=-53.5kJ·mol-1.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应,假设Al3+、Mg2+结合OH-的能力相同),产生沉淀的物质的量与所加溶液的体积的关系如图所示。下列说法正确的是:
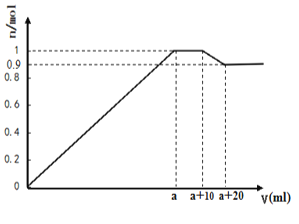
A. 当a<V<a+10时,不再生成难溶物
B. 上述含Al3+、Mg2+、Ba2+的混合溶液中3c(Al3+)+2c(Mg2+)=c(Ba2+)
C. 上述含Al3+、Mg2+、Ba2+的混合溶液中n(Al3+) = 0.2mol
D. NaOH和Na2SO4的混合溶液中c(NaOH)>c(Na2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
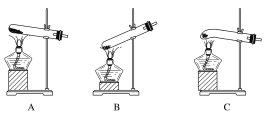
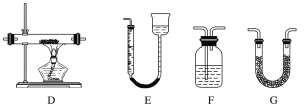
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
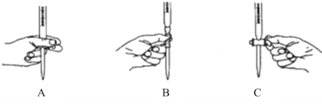
③判断反应达到滴定终点时的现象为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验硫酸根离子的存在时,先在待测溶液中加入盐酸,其作用是
A. 形成较多的白色沉淀
B. 形成的沉淀纯度更高
C. 排除硫酸根离子以外其他阴离子及银离子的干扰
D. 排除钡离子以外的其他阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酒精厂由于管理不善,酒精滴漏到某种化学药品上而酿成火灾。该化学药品可能是( )
A. KMnO4 B. NaCl C. (NH4)2SO4 D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高一学生小强的化学笔记中有如下内容,你认为他的笔记中有几处错误( )
①依据水溶液能否导电将物质分为电解质与非电解质
②单质可分为金属单质和非金属单质
③化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤溶液呈电中性,胶体带有电荷
A.二处B.三处C.四处D.五处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.恒温、恒容条件下,在工业合成氨反应中,增加氢气的量
D.在H2SO4与NaOH两溶液反应时,增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com