
【题目】在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应,假设Al3+、Mg2+结合OH-的能力相同),产生沉淀的物质的量与所加溶液的体积的关系如图所示。下列说法正确的是:
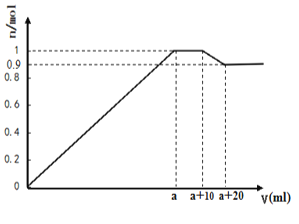
A. 当a<V<a+10时,不再生成难溶物
B. 上述含Al3+、Mg2+、Ba2+的混合溶液中3c(Al3+)+2c(Mg2+)=c(Ba2+)
C. 上述含Al3+、Mg2+、Ba2+的混合溶液中n(Al3+) = 0.2mol
D. NaOH和Na2SO4的混合溶液中c(NaOH)>c(Na2SO4)
【答案】C
【解析】
在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液,0~a mL时,图像为一条倾斜直线,可以推得生成Al(OH)3、Mg(OH)2、BaSO4沉淀,在a mL到(a+10)mL之间,图像为一条水平直线,可以推得沉淀一边生成一边溶解,且溶解的Al(OH)3和生成的BaSO4物质的量相等,则c(NaOH)=c(Na2SO4)。在(a+10)mL到(a+20)mL之间,沉淀一直溶解,反应为:Al(OH)3+OH-=AlO2-+2H2O,据此分析;
A.a mL到(a+10)mL之间,包含Al(OH)3的溶解和BaSO4的生成,故A项错误;
B.由图可知,当Al3+、Mg2+沉淀完全时,Ba2+还未沉淀完全,且NaOH和Na2SO4的混合溶液中c(NaOH)=c(Na2SO4),则3c(Al3+)+2c(Mg2+)<c(Ba2+),故B项错误;
C.在(a+10)mL到(a+20)mL之间,沉淀一直溶解,反应为:Al(OH)3+OH-=AlO2-+2H2O,可以看出滴加10mL混合溶液有0.1molAl(OH)3溶解,同理在a mL到(a+10)mL之间滴加10mL混合溶液也有0.1molAl(OH)3溶解,所以一共有0.2molAl(OH)3溶解,可以推得混合溶液中n(Al3+) = 0.2mol,故C项正确;
D.在a mL到(a+10)mL之间,图像为一条水平直线,可以推得沉淀一边生成一边溶解,且溶解的Al(OH)3和生成的BaSO4物质的量相等,则c(NaOH)=c(Na2SO4),故D项错误;
综上,本题选C。


科目:高中化学 来源: 题型:
【题目】检验二氧化硫气体中是否混有二氧化碳气体,可采用的方法是
A.通过品红溶液
B.先通过氢氧化钠溶液,再通过澄清石灰水
C.先通过饱和碳酸氢钠溶液,再通过澄清石灰水
D.先通过酸性高锰酸钾溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是
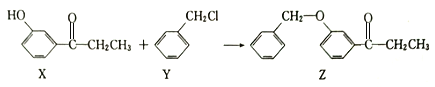
A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是:
A. NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+==BaCO3↓+H2O
B. 钠与水反应的离子方程式为:Na+H2O===Na++OH-+H2↑
C. HS-的电离方程式为:HS-+H2O![]() H2S+OH-
H2S+OH-
D. c(H+)=1.0mol/L的溶液中Na+、Al3+、NO![]() 、I-不能大量共存
、I-不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、100 g 16.0%的的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
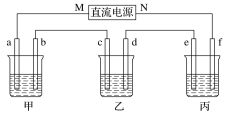
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为12.20%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为________极。
(2)电极b上发生的电极反应式为____________________________________________
(3)电极b上生成的气体在标准状况下的体积_________________。
(4)电极c的质量变化是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是

A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y=2Z,如图所示是该反应中X的物质的量随时间变化的曲线。

(1)2 min内的平均速率是________;
(2)4 min内的平均速率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液在如下图所示的装置中 进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
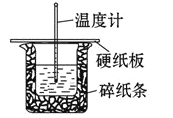
(1)从实验装置上看,图中缺少的一种玻璃仪器是_____。
(2)烧杯间填满碎纸条的作用是_____。
(3)若大烧杯上不盖硬纸板,求得的反应热数值______填“偏大”“偏小”或“无影响”)。
(4)若取取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为 0.50 mol/L NaOH 溶液和 0.50 mol/L 硫酸溶液的密度都是 1 g/cm3,中和后生成溶液 的比热容 c=4.18 J/(g·℃)。则中和热△H=_____(取小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com