
【题目】下列判断正确的是:
A. NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+==BaCO3↓+H2O
B. 钠与水反应的离子方程式为:Na+H2O===Na++OH-+H2↑
C. HS-的电离方程式为:HS-+H2O![]() H2S+OH-
H2S+OH-
D. c(H+)=1.0mol/L的溶液中Na+、Al3+、NO![]() 、I-不能大量共存
、I-不能大量共存
【答案】D
【解析】
A.结合HCO3-与OH-的反应实质,以及反应物用量进行分析;
B.将Na与水的化学反应方程式拆写成离子反应方程式;
C.HS-+H2O![]() H2S+OH-为HS-的水解方程式;
H2S+OH-为HS-的水解方程式;
D.酸性条件下,硝酸根与碘离子发生氧化还原反应不共存;
A.NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:2HCO3-+2OH-+Ba2+==BaCO3↓+H2O+ CO32-,故A项错误;
B.钠与水反应的离子方程式为:2Na+2H2O =2Na++2OH-+H2↑,故B项错误;
C.HS-的电离方程式为:HS-+H2O![]() S2-+H+,故C项错误;
S2-+H+,故C项错误;
D.c(H+)=1.0mol/L的溶液呈现酸性,酸性条件下,硝酸可以氧化I-,不能大量共存,故D项正确;
综上,本题选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
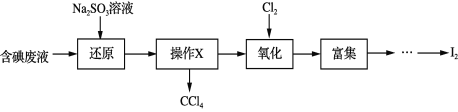
下列叙述不正确的是
A. “操作X”的名称为萃取,可在分液漏斗中进行
B. “还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
C. “氧化”过程中,可用双氧水替代氯气
D. “富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是( )
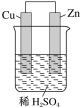
①铜为阳极,锌为阴极;②铜极上有气泡;③SO![]() 向铜极移动;④若有0.5mol电子流经导线,则可产生5.6L气体;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-===Zn2+
向铜极移动;④若有0.5mol电子流经导线,则可产生5.6L气体;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-===Zn2+
A. ①② B. ①④⑥ C. ②④⑥ D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
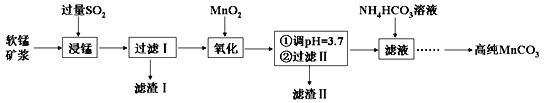
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
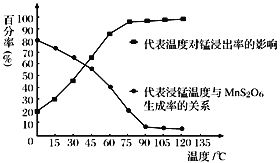
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是 ( )


A. 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B. 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变
C. 图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼
D. 图4装置中若M是铜,则该装置能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的含有Al3+、Mg2+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应,假设Al3+、Mg2+结合OH-的能力相同),产生沉淀的物质的量与所加溶液的体积的关系如图所示。下列说法正确的是:
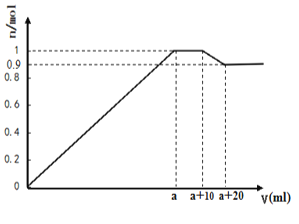
A. 当a<V<a+10时,不再生成难溶物
B. 上述含Al3+、Mg2+、Ba2+的混合溶液中3c(Al3+)+2c(Mg2+)=c(Ba2+)
C. 上述含Al3+、Mg2+、Ba2+的混合溶液中n(Al3+) = 0.2mol
D. NaOH和Na2SO4的混合溶液中c(NaOH)>c(Na2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的溶液,下列操作中正确的是( )
A. 称量时,应先在两盘上放等质量的纸,再将固体NaOH放在天平左盘上称量
B. 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C. 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D. 定容时如果加水超过了刻度线,用胶头滴管再吸出多余部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入气体X和气体Y反应生成气体Z,从反应开始到建立化学平衡,用X、Y、Z分别表示的化学反应速率为v(X)、v(Y)、v(Z)有以下关系:v(X)=3v(Y)、2v(Y)=v(Z),则此反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com