
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
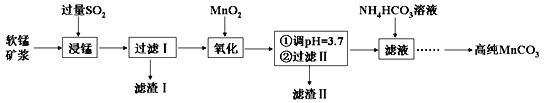
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
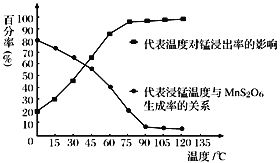
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
【答案】SiO2 2Fe2++MnO2+4H+![]() 2Fe3++Mn2++2H2O 90℃ 防止NH4HCO3受热分解,提高原料的利用率 Mn2++2HCO3—=MnCO3↓+CO2↑+H2O 取1-2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明洗涤干净
2Fe3++Mn2++2H2O 90℃ 防止NH4HCO3受热分解,提高原料的利用率 Mn2++2HCO3—=MnCO3↓+CO2↑+H2O 取1-2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明洗涤干净
【解析】
向软锰矿中通入过量的二氧化硫浸锰,酸性条件下,利用二氧化硫的还原性将二氧化锰、氧化铁粉末还原为硫酸锰和硫酸亚铁,过滤,滤渣Ⅰ为二氧化硅,向滤液中加入过量的二氧化锰,过量的二氧化硫和二氧化锰反应生成硫酸锰。将亚铁离子氧化为铁离子,调节pH=3.7,将铁离子转化为氢氧化铁沉淀,过滤,滤渣Ⅱ为氢氧化铁和二氧化锰,滤液为硫酸锰溶液,向滤液中加入少量的碳酸氢铵溶液,发生反应Mn2++2HCO3—=MnCO3↓+CO2↑+H2O,过滤,洗涤,干燥,得碳酸锰。
向软锰矿中通入过量的二氧化硫浸锰,酸性条件下,利用二氧化硫的还原性将二氧化锰,氧化铁粉末还原为硫酸锰和硫酸亚铁,过滤,滤渣Ⅰ为二氧化硅,向滤液中加入过量的二氧化锰,过量的二氧化硫和二氧化锰反应生成硫酸锰。将亚铁离子氧化为铁离子,调节pH=3.7,将铁离子转化为氢氧化铁沉淀,过滤,滤渣Ⅱ为氢氧化铁和二氧化锰,滤液为硫酸锰溶液,向滤液中加入少量的碳酸氢铵溶液,发生反应Mn2++2HCO3—=MnCO3↓+CO2↑+H2O,过滤,洗涤,干燥,得碳酸锰。
(1) 过滤,滤渣Ⅰ为SiO2;
(2)亚铁离子被二氧化锰氧化生成铁离子,离子方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)分析图象可知温度在90℃以后MnS2O6的生成率较低,锰的浸出率较高,且温度较低节约能源,故浸锰的适宜温度为90℃;
(4)铵盐受热分解,向过滤所得的滤液中加入碳酸氢铵溶液,温度控制在30-35℃的原因是防止NH4HCO3受热分解,提高原料的利用率;
(5)硫酸锰和碳酸氢铵溶液反应生成碳酸锰沉淀和二氧化碳和水,离子方程式为:Mn2++2HCO3—=MnCO3↓+CO2↑+H2O;
(6)生成的碳酸锰沉淀表面有硫酸根离子等杂质离子,检验沉淀是否洗涤干净可检验最后一次洗涤液中是否含有硫酸根离子,方法是取1-2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明洗涤干净。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.苯酚与乙醇的官能团都是羟基
B.炔烃的官能团是碳碳双键
C.官能团是反映一类化合物物理性质的原子或原子团
D.饱和一元羧酸的通式为CnH2n+2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DNA是主要的遗传物质,在绿色植物细胞内,它分布于( )
A. 细胞核、细胞质基质 B. 细胞核、核糖体
C. 细胞核、内质网 D. 细胞核、叶绿体、线粒体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是
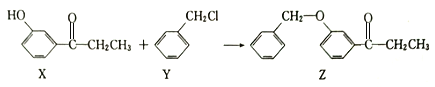
A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是:
A. NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+==BaCO3↓+H2O
B. 钠与水反应的离子方程式为:Na+H2O===Na++OH-+H2↑
C. HS-的电离方程式为:HS-+H2O![]() H2S+OH-
H2S+OH-
D. c(H+)=1.0mol/L的溶液中Na+、Al3+、NO![]() 、I-不能大量共存
、I-不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是

A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去氯化钠中少量的氯化钙、硫酸钠杂质,下列选用的试剂及加入顺序正确的是
A. Na2CO3、BaCl2、HCl B. BaCl2、Na2CO3、H2SO4
C. BaCl2、Na2CO3、HCl D. Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com