
،¾جâؤ؟،؟(1)؛¬11.2 g KOHµؤد،بـز؛سë1 L0.1mol/LµؤH2SO4بـز؛·´س¦·إ³ِ11.46 kJµؤببء؟£¬¸أ·´س¦±يت¾ضذ؛حببµؤبب»¯ر§·½³جت½خھ___________________،£
(2)½«0.40 mol N2O4ئّجه³نبë2 Lµؤ؛مبفأـ±صبفئ÷ضذ·¢ةْبçدآ·´س¦£؛N2O4(g) ![]() 2NO2(g)¦¤H،£شعT1،و؛حT2،وت±£¬²âµأNO2µؤخïضتµؤء؟ثوت±¼ن±ن»¯بçح¼ثùت¾£؛
2NO2(g)¦¤H،£شعT1،و؛حT2،وت±£¬²âµأNO2µؤخïضتµؤء؟ثوت±¼ن±ن»¯بçح¼ثùت¾£؛

¢ظT1،و£¬40،«80 sؤعسأN2O4±يت¾¸أ·´س¦µؤئ½¾ù·´س¦ثظآتخھ________mol/(L،¤s)،£
¢ع¦¤H________0(جî،°>،±،¢،°<،±»ٍ،°=،±)،£
(3)دٍ¼×،¢ززء½¸ِبف»¾ùخھ1 Lµؤ؛مبفبفئ÷ضذ£¬·ض±ً³نبë2 mol A،¢2 mol B؛ح1 mol A،¢1 mol B،£دàح¬جُ¼دآ(خآ¶بT ،و)£¬·¢ةْدآءذ·´س¦£؛A(g)+B(g)![]() xC(g) ¦¤H<0،£²âµأء½بفئ÷ضذc(A)ثوت±¼نtµؤ±ن»¯بçح¼ثùت¾:
xC(g) ¦¤H<0،£²âµأء½بفئ÷ضذc(A)ثوت±¼نtµؤ±ن»¯بçح¼ثùت¾:

¢ظ¼×بفئ÷ئ½؛â؛َخïضتBµؤ×ھ»¯آتخھ_______£»
¢عT،و ت±¸أ·´س¦µؤئ½؛â³£تخھ________،£
(4)شع25 ،ودآ£¬½«a mol/Lµؤ°±ث®سë0.01mol/Lµؤرخثلµبجه»»ى؛د£¬·´س¦ئ½؛âت±بـز؛ضذc(NH4+)=c(Cl-)،£
¢ظشٍبـز؛دش________ذش(جî،°ثل،±،°¼î،±»ٍ،°ضذ،±)£»
¢عسأ؛¬aµؤ´ْتت½±يت¾NH3،¤H2Oµؤµçہë³£تKb£½__________________،£
،¾´ً°¸،؟KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l)،،¦¤H=£57.3kJ/mol 0.00125 > 61% 2 ضذ
K2SO4(aq)+H2O(l)،،¦¤H=£57.3kJ/mol 0.00125 > 61% 2 ضذ ![]()
،¾½âخِ،؟
(1)دب¼ئثمKOH،¢H2SO4µؤخïضتµؤء؟£¬ب»؛َإذ¶دؤؤضضخïضت¹ء؟£¬ب·¶¨·´س¦²ْةْ1molز؛ج¬ث®·إ³ِµؤببء؟£¬¼´µأ¸أ·´س¦µؤضذ؛حببµؤبب»¯ر§·½³جت½£»
(2)¢ظ Tl،وت±£¬40s،«80sؤع¶رُ»¯µھµؤخïضتµؤء؟´س0.40mol±نخھ0.60mol£¬¸ù¾فv=![]() ¼ئثم³ِسأ¶رُ»¯µھ±يت¾µؤئ½¾ù·´س¦ثظآت£¬ب»؛َ¸ù¾ف·´س¦ثظآتس뻯ر§¼ئء؟ت³ةص±ب¼ئثم³ِسأN2O4±يت¾µؤئ½¾ù·´س¦ثظآت£»
¼ئثم³ِسأ¶رُ»¯µھ±يت¾µؤئ½¾ù·´س¦ثظآت£¬ب»؛َ¸ù¾ف·´س¦ثظآتس뻯ر§¼ئء؟ت³ةص±ب¼ئثم³ِسأN2O4±يت¾µؤئ½¾ù·´س¦ثظآت£»
¢ع¸ù¾فح¼دَاْدك±ن»¯؟ةضھ£¬Tl،وت±·´س¦ثظآت´َسعT2،و£¬ازT2،و´ïµ½ئ½؛âت±¶رُ»¯µھµؤخïضتµؤء؟ذ،سعTl،و£¬¸ù¾فخآ¶ب¶ش»¯ر§ئ½؛âµؤس°دىإذ¶د¸أ·´س¦µؤ·´س¦بب£»
(3)¢ظدب¸ù¾فح¼ت¾¼ئثم³ِ¼×بفئ÷ضذAµؤ×ھ»¯ء؟£¬شظ½ل؛د·½³جت½ضذA،¢Bµؤ×ھ»»¹طدµ£¬¼ئثم³ِBµؤ×ھ»¯ء؟£¬×î؛َ¸ù¾ف×ھ»¯آتµبسع×ھ»¯ء؟سë×ـء؟µؤ±بµأµ½¸أخïضتµؤ×ھ»¯آت£»
¢ع¼ئثم¼×،¢ززبفئ÷ضذAµؤ×ھ»¯آت£¬شظ¸ù¾فر¹ا؟¶شA×ھ»¯آتµؤس°دىہ´ب·¶¨xضµ£¬½ّ¶ّہûسأب¶خت½µأµ½¸أ·´س¦ئ½؛âت±µؤخïضتµؤء؟إ¨¶ب£¬´ّبëئ½؛â³£ت±ي´ïت½£¬؟ة¼ئثم³ِئنئ½؛â³£تµؤضµ£»
(4)°±ث®سëرخثل·¢ةْ·´س¦HCl+NH3H2O¨TNH4Cl+H2O£¬¸ù¾فµç؛ةتط؛م·ضخِبـز؛µؤثل¼îذش£¬شظ¸ù¾فئ½؛âإ¨¶ب¼ئثم°±ث®µؤµçہë³£ت،£
(1)11.2g¼´0.2molKOHµؤد،بـز؛سë1L،¢0.1mol/LµؤH2SO4بـز؛·´س¦·إ³ِ11.46kJµؤببء؟£¬ئنضذ¼î؛¬سذµؤOH-µؤخïضتµؤء؟تا0.2mol£¬ثلبـز؛؛¬سذµؤH+µؤخïضتµؤء؟خھ0.1mol/L،ء1L،ء2=0.2mol£¬¶صكا،؛أ·´س¦ةْ³ة0.2molث®£¬·إ³ِ11.46kJµؤببء؟شٍ·´س¦²ْةْ1molث®·إ³ِببء؟خھ11.46kJ،آ0.2=57.3kJ£¬زٍ´ث¸أ·´س¦µؤ±يت¾ضذ؛حببµؤبب»¯ر§·½³جت½خھ£؛KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l)،،¦¤H=£57.3kJ/mol£»
K2SO4(aq)+H2O(l)،،¦¤H=£57.3kJ/mol£»
(2)¢ظTl،وت±£¬40s،«80sؤع¶رُ»¯µھµؤخïضتµؤء؟´س0.40mol±نخھ0.60mol£¬شٍسأ¶رُ»¯µھ±يت¾¸أت±¼ن¶خµؤئ½¾ù·´س¦ثظآتخھ£؛v(NO2)=![]() =0.0025mol/£¨Ls£©£¬»¯ر§·´س¦ثظآتس뻯ر§¼ئء؟ت³ةص±ب£¬شٍv(N2O4)=
=0.0025mol/£¨Ls£©£¬»¯ر§·´س¦ثظآتس뻯ر§¼ئء؟ت³ةص±ب£¬شٍv(N2O4)=![]() v(NO2)=0.00125mol/£¨Ls£©£»
v(NO2)=0.00125mol/£¨Ls£©£»
¢ع¸ù¾فح¼دَاْدك±ن»¯؟ةضھ£¬Tl،وت±·´س¦ثظآت´َسعT2،و£¬شٍخآ¶ب´َذ،خھ£؛Tl،و£¾T2،و£¬¶ّشعT2،و´ïµ½ئ½؛âت±¶رُ»¯µھµؤخïضتµؤء؟ذ،سعTl،و£¬ثµأ÷ة¸كخآ¶ب£¬ئ½؛âدٍص·´س¦·½دٍزئ¶¯£¬شٍ¸أ·´س¦خھخüبب·´س¦£¬،÷H£¾0£»
(3)¢ظ¼×بفئ÷ضذA·´س¦µؤخïضتµؤء؟خھ،÷n(A)=(2-0.78)mol/L،ء1L=1.22mol£¬¸ù¾فA؛حBµؤ¹طدµت½ضھ£¬²خ¼س·´س¦µؤBµؤخïضتµؤء؟ز²تا1.22mol£¬شٍBµؤ×ھ»¯آت=![]() ،ء100%=61%£»
،ء100%=61%£»
¢ع¼×بفئ÷·´س¦´ïµ½ئ½؛â؛َ£¬c(A)0.78mol/L£¬Aµؤ×ھ»¯آت=![]() ،ء100%=61%£»ززبفئ÷ضذ£¬Aµؤ×ھ»¯آت=
،ء100%=61%£»ززبفئ÷ضذ£¬Aµؤ×ھ»¯آت=![]() ،ء100%=50%£¬¼´ر¹ا؟ش½´َ£¬Aµؤ×ھ»¯آتش½¸ك£¬ثµأ÷¸أ·´س¦µؤص·´س¦تائّجهجه»¼ُذ،µؤ·´س¦£¬زٍ´ثx=1،£·´س¦·½³جت½خھ£؛
،ء100%=50%£¬¼´ر¹ا؟ش½´َ£¬Aµؤ×ھ»¯آتش½¸ك£¬ثµأ÷¸أ·´س¦µؤص·´س¦تائّجهجه»¼ُذ،µؤ·´س¦£¬زٍ´ثx=1،£·´س¦·½³جت½خھ£؛
A(g) + B(g) ![]() C(g)
C(g)
c(ت¼)(mol/L) 2 2 0
c(±ن)(mol/L) 1.2 1.22 1.22
c(ئ½)(mol/L) 0.78 0.78 1.22
ثùزش¸أ·´س¦µؤئ½؛â³£تK=![]() =2£»
=2£»
(4)¢ظ°±ث®سëرخثل·¢ةْ·´س¦HCl+NH3H2O¨TNH4Cl+H2O£¬¸ù¾فµç؛ةتط؛م£؛c(NH4+)+c(H+)=c(OH-)+c(Cl-)£¬·´س¦ئ½؛âت±بـز؛c(NH4+)=c(Cl-)£¬شٍبـز؛ضذc(H+)=c(OH-)£¬ثùزشبـز؛³تضذذش£»
¢عئ½؛âت±سةسعc(NH4+)=c(Cl-)£¬شٍc(NH4+)=![]() =0.005mol/L£¬¸ù¾فخïءدتط؛م؟ةµأc(NH3H2O)=
=0.005mol/L£¬¸ù¾فخïءدتط؛م؟ةµأc(NH3H2O)=![]() mol/L-0.005mol/L=(
mol/L-0.005mol/L=(![]() -0.005)mol/L£¬بـز؛خھضذذش£¬شٍc(OH-)=10-7mol/L£¬ثùزشNH3H2Oµؤµçہë³£تKb=
-0.005)mol/L£¬بـز؛خھضذذش£¬شٍc(OH-)=10-7mol/L£¬ثùزشNH3H2Oµؤµçہë³£تKb=![]() ،£
،£



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟·´س¦2A(g)![]() 2B(g)£«E(g)،،¦¤H>0£¬´ïµ½ئ½؛âت±£¬زھت¹ص·´س¦ثظآت½µµح£¬Aµؤإ¨¶بشِ´َ£¬س¦²ةب،µؤ´ëت©تا(،،،،)
2B(g)£«E(g)،،¦¤H>0£¬´ïµ½ئ½؛âت±£¬زھت¹ص·´س¦ثظآت½µµح£¬Aµؤإ¨¶بشِ´َ£¬س¦²ةب،µؤ´ëت©تا(،،،،)
A. ¼سر¹ B. ةخآ C. ¼ُةظEµؤإ¨¶ب D. ½µخآ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟سذ»ْخïGتاؤ³ضضز©خï؛د³ةµؤضذ¼نجه£¬ئن؛د³ةآ·دكبçدآ£؛
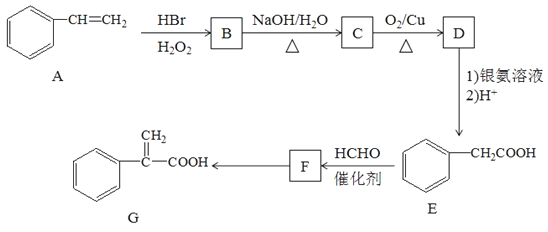
زرضھ£؛¢ظCH3-CH=CH2+HBr![]() CH3-CH2-CH2Br
CH3-CH2-CH2Br
¢عCH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
اë»ط´ًدآءذختجâ£؛
£¨1£©Aµؤأû³ئخھ___________________________،£
£¨2£©Fضذ¹ظؤـحإأû³ئتا______________________________£»E×ھ»¯Fµؤ·´س¦ہàذحتا_________________،£
£¨3£©F×ھ»¯خھGµؤ»¯ر§·½³جت½£؛_________________________________________،£
£¨4£©»¯؛دخïFسذ¶àضضح¬·ضزى¹¹جه£¬آْ×مدآءذجُ¼µؤح¬·ضزى¹¹جهسذ__________ضض،£
¢ظتôسع·¼دم×ه»¯؛دخïاز±½»·ةدسذء½¸ِب،´ْ»ù£»
¢عؤـ·¢ةْث®½â·´س¦؛حزّ¾µ·´س¦£»
¢غسëFeCl3بـز؛·¢ةْدشة«·´س¦،£
ئنضذ؛ث´إ¹²صٌاâئ×ح¼سذ6×é·هاز·هأو»ض®±بخھ1£؛2£؛2£؛2£؛2£؛1µؤسذ»ْخïµؤ½ل¹¹¼ٍت½خھ__________________£»
£¨5£©²خصصةدتِ؛د³ةآ·دكةè¼ئز»جُسةCH3CHBrCH3؛حC2H5OHضئ±¸CH3CH2COOC2H5µؤ؛د³ةآ·دك£¨ئنثûتش¼ء×شر،£©______________
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟شعجه»¹ج¶¨µؤأـ±صبفئ÷ضذ£¬¼سبë2molA؛ح1molB·¢ةْدآءذ·´س¦²¢از´ïµ½»¯ر§ئ½؛â×´ج¬£¬2A(g)+B(g) ![]() 3C(g)+D(g)£¬ئ½؛âت±Cµؤإ¨¶بخھamol،¤L£1،£بôخ¬³ضبفئ÷جه»؛حخآ¶ب²»±ن£¬°´دآءذ4ضض·½·¨إن±ب×÷خھئًت¼خïضت³نبë¸أبفئ÷ضذ£¬´ïµ½ئ½؛â؛َ£¬Cµؤإ¨¶ببشخھamol،¤L£1µؤتا( )
3C(g)+D(g)£¬ئ½؛âت±Cµؤإ¨¶بخھamol،¤L£1،£بôخ¬³ضبفئ÷جه»؛حخآ¶ب²»±ن£¬°´دآءذ4ضض·½·¨إن±ب×÷خھئًت¼خïضت³نبë¸أبفئ÷ضذ£¬´ïµ½ئ½؛â؛َ£¬Cµؤإ¨¶ببشخھamol،¤L£1µؤتا( )
A£®4molA+2molB B£®3molC+1molB+1molD+1molA
C£®2molA+1molB+1molD D£®1molA+0.5molB + 1.5molC+0.5molD
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟³£خآدآ£¬pH¾ùخھ2،¢جه»¾ùخھV0µؤHA،¢HB،¢HCبـز؛£¬·ض±ً¼سث®د،تحضءجه»خھV£¬بـز؛pHثوlg![]() µؤ±ن»¯¹طدµبçح¼ثùت¾£¬دآءذذًتِ´يخَµؤتا( )
µؤ±ن»¯¹طدµبçح¼ثùت¾£¬دآءذذًتِ´يخَµؤتا( )
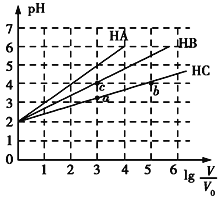
A. ³£خآدآ£؛Ka(HB)>Ka(HC)
B. HCµؤµçہë¶ب£؛aµم<bµم
C. µ±lg![]() =4ت±£¬بضضبـز؛ح¬ت±ة¸كخآ¶ب£¬
=4ت±£¬بضضبـز؛ح¬ت±ة¸كخآ¶ب£¬![]() ¼ُذ،
¼ُذ،
D. µ±lg![]() =5ت±£¬HAبـز؛µؤpHخھ7
=5ت±£¬HAبـز؛µؤpHخھ7
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟£¨I£©²فثلµؤ×é³ةسأH2C2O4±يت¾£¬خھءث²â¶¨ؤ³²فثلبـز؛µؤإ¨¶ب£¬½ّذذبçدآتµرé£؛³ئب،Wg²فثل¾§جه£¬إن³ة100.00mLث®بـز؛£¬ب،25.00mLثùإنضئµؤ²فثلبـز؛ضأسع׶ذخئ؟ؤع£¬¼سبëتتء؟د،H2SO4؛َ£¬سأإ¨¶بخھamolL©پ1µؤKMnO4بـز؛µخ¶¨µ½KMnO4²»شظحتة«خھض¹£¬ثù·¢ةْµؤ·´س¦خھ£؛2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2،ü+2MnSO4+8H2O£®
تش»ط´ً£؛
£¨1£©تµرéضذ£¬±ê×¼ز؛KMnO4بـز؛س¦×°شع_____ت½µخ¶¨¹ـضذ£¬زٍخھ______________£»
£¨2£©تµرéضذرغ¾¦×¢تس_____________________£¬ض±ضءµخ¶¨ضصµم£®إذ¶دµ½´ïضصµمµؤدضدَتا_________£»
£¨3£©تµرéضذ£¬دآءذ²ظ×÷£¨ئنثü²ظ×÷¾ùصب·£©£¬»ل¶شثù²â²فثلإ¨¶بسذت²أ´س°دى£؟£¨جîئ«´َ،¢ئ«ذ،،¢خقس°دى£©
A£®µخ¶¨ا°رِتس؟ج¶ب£¬µخ¶¨؛َ¸©تس؟ج¶ب_________£»
B£®×¶ذخئ؟شعت¢·إ´²âز؛ا°خ´¸ةشسذةظء؟صôءَث®_________£»
C£®µخ¶¨¹³جضذز،¶¯×¶ذخئ؟£¬²»ة÷½«ئ؟ؤعµؤبـز؛½¦³ِز»²؟·ض_________£»
£¨II£©سأ50mL 0.50mol/Lرخثلسë50mL 0.55mol/L NaOHبـز؛شعبçح¼ثùت¾µؤ×°ضأضذ½ّذذضذ؛ح·´س¦£®ح¨¹²â¶¨·´س¦¹³جضذثù·إ³ِµؤببء؟؟ة¼ئثمضذ؛حبب،£»ط´ًدآءذختجâ£؛

£¨1£©´ستµرé×°ضأةد؟´£¬ح¼ضذةذب±ةظµؤز»ضض²£ء§سأئ·تا_________£®
£¨2£©ةص±¼نجîآْثéض½جُµؤ×÷سأتا_________________________________£®
£¨3£©زہ¾ف¸أر§ةْµؤتµرéت¾ف¼ئثم£¬¸أتµرé²âµأµؤضذ؛حبب،÷H£½___________£»£¨½ل¹û±£ءôز»خ»ذ،ت£©
ذٍ؛إ | ئًت¼خآ¶بt1،و | ضصض¹خآ¶بt2،و | |
رخثل | اâرُ»¯ؤئبـز؛ | »ى؛دبـز؛ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ؤ³ذ،×éخھرذ¾؟شµç³طشہي£¬ةè¼ئبçح¼×°ضأ،£دآءذذًتِصب·µؤتا( )
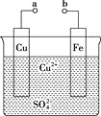
A. a؛حb²»ء¬½ست±£¬جْئ¬ةد»لسذ![]() ²ْةْ
²ْةْ
B. a؛حbسأµ¼دكء¬½ست±£¬جْئ¬ةد·¢ةْµؤ·´س¦خھ![]()
C. a؛حbسأµ¼دكء¬½ست±£¬µç×سسةaء÷دٍb
D. خقآغa؛حbتا·ٌء¬½س£¬جْئ¬¾ù»لبـ½â£¬بـز؛´سہ¶ة«ضً½¥±ن³ةا³آج
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ؤ³»¯ر§ذثب¤ذ،×éµؤح¬ر§سأبçح¼ثùت¾×°ضأرذ¾؟سذ¹طµç»¯ر§µؤختجâ،£µ±±ص؛د¸أ×° ضأµؤ؟ھ¹طت±£¬¹غ²ىµ½µçء÷±يµؤض¸صë·¢ةْءثئ«×ھ،£

اë»ط´ًدآءذختجâ£؛
£¨1£©¼×³طخھ_____(جî،°شµç³ط،±،°µç½â³ط،±»ٍ،°µç¶ئ³ط،±)£¬ح¨بë CH3OH µç¼«µؤµç¼«·´س¦خھ_____،£
£¨2£©زز³طضذ A(ت¯ؤ«)µç¼«µؤأû³ئخھ_____(جî،°ص¼«،±،°¸؛¼«،±»ٍ،°زُ¼«،±،°رô¼«،±)£¬×ـ·´س¦خھ__________،£
£¨3£©µ±زز³طضذ B ¼«ضتء؟شِ¼س 5.4 g ت±£¬¼×³طضذہيآغةددû؛ؤ O2 µؤجه»خھ_____mL(±ê×¼×´ ؟ِ)£¬±û³طضذ_____(جî،°C،±»ٍ،°D،±)¼«خِ³ِ_____g ح،£
£¨4£©بô±ûضذµç¼«²»±ن£¬½«ئنبـز؛»»³ة NaCl بـز؛£¬؟ھ¹ط±ص؛دز»¶خت±¼ن؛َ£¬¼×ضذبـز؛µؤ pH½«_____(جî،°شِ´َ،±،°¼ُذ،،±»ٍ،°²»±ن،±£¬دآح¬)£¬±ûضذبـز؛µؤ pH ½«______،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟298Kت±£¬سأ0.1000mol،¤L-1د،ءٍثلµخ¶¨20.00mL 0.1000mol،¤L-1°±ث®£¬بـز؛ضذث®µؤµçہë³ج¶بثوثù¼سد،ءٍثلجه»µؤ±ن»¯بçح¼ثùت¾،£دآءذثµ·¨²»صب·µؤتا
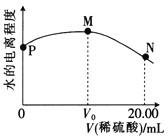
A. ¸أتµرé؟ةر،شٌ¼×»ù³ب×÷ض¸ت¾¼ء
B. ´سPµمµ½Nµم£¬بـز؛ضذث®µؤµçہë³ج¶بدبشِ´َ؛َ¼ُذ،
C. Mµم¶شس¦µؤبـز؛ضذ£؛c(H+)=c(OH-)+c(NH3،¤H2O)
D. Nµم¶شس¦µؤبـز؛ضذ£؛c(NH4+)+c(NH3،¤H2O)=2c(SO42-)
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com