
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
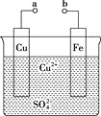
A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于钠的化合物的叙述错误的是( )
A.过氧化钠可用于呼吸面具中作为氧气的来源
B.过氧化钠与水反应放出氢气
C.碳酸钠进行焰色反应,火焰呈黄色
D.常温下,氧化钠是白色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) ![]() 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:

①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________mol/(L·s)。
②ΔH________0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______;
②T℃ 时该反应的平衡常数为________。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验硫酸根离子的存在时,先在待测溶液中加入盐酸,其作用是
A. 形成较多的白色沉淀
B. 形成的沉淀纯度更高
C. 排除硫酸根离子以外其他阴离子及银离子的干扰
D. 排除钡离子以外的其他阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有两种溶质 NaCl 和 H2SO4,它们的物质的量之比为 3∶1。用石墨作电极电 解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A. 阴极自始至终只逸出 H2 B. 阳极先逸出 Cl2,后逸出 O2
C. 溶液 pH 不断增大,最后为 7 D. 电解最后阶段为电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40 mol的四氧化二氮气体充入2 L的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.20 | a | 0.10 | c | d | e |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应的化学方程式为________________________。
(2)该反应在0~20 s内N2O4的平均反应速率为____________。
(3)在80℃时该反应的平衡常数K值为______________。
(4)在20s时,浓度熵Qc_________(填“>”、“<”或“=”)平衡常数K。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl
B.2Na2O2+2H2O=4NaOH+O2↑
C.2N2O5(g)=4NO2(g)+O2(g)
D.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com