
【题目】下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl
B.2Na2O2+2H2O=4NaOH+O2↑
C.2N2O5(g)=4NO2(g)+O2(g)
D.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
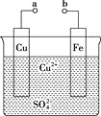
A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为()
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 硫酸钡 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 乙醇 |
D | 碘酒 | 食盐水 | 氯化铜 | 碳酸钙 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.1000mol·L-1稀硫酸滴定20.00mL 0.1000mol·L-1氨水,溶液中水的电离程度随所加稀硫酸体积的变化如图所示。下列说法不正确的是
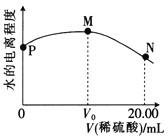
A. 该实验可选择甲基橙作指示剂
B. 从P点到N点,溶液中水的电离程度先增大后减小
C. M点对应的溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. N点对应的溶液中:c(NH4+)+c(NH3·H2O)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第三周期主族元素性质特征的是
A. 从左到右原子半径逐渐减小
B. 从左到右非金属性逐渐增强
C. 从左到右金属元素的最高价氧化物的水化物的碱性逐渐减弱
D. 从左到右非金属元素的氧化物的水化物的酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 使用催化剂是为了加快反应速率,提高原料的利用率
B. 燃烧一定都是放热反应
C. 燃烧必须要有氧气参与反应
D. 电解水和氢气在氧气中燃烧是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。
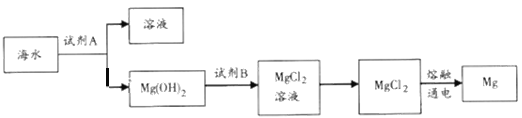
①工业上常用于沉淀Mg2+的试剂A是__________(填化学式),Mg(OH)2转化为MgCl2的离子方程式为________________________。
②由无水MgCl2制取Mg的化学方程式是______________________。
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是__________(填名称);
②向酸化的滤液中加过氧化氢溶液,该反应的离子方程式为__________;
③反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
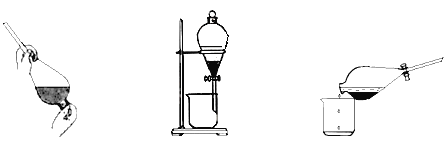
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,错误的是__________(填“甲”、“乙”或“丙”)。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
若从100L该海水中提取镁,理论上需加入试剂A__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com