
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
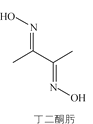
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
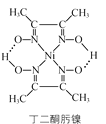
a.配位键 b. 离子键 c. 氢键 d. 范德华力
(4)某镍白铜的晶胞如图所示,其化学式为________。
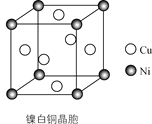
【答案】3d84s2 N>O>C 15 mol sp2和sp3 ac Cu3Ni
【解析】
(1)Ni为第27号元素,其基态价电子排布式为3d84s2;第一电离能总的趋势为同一周期从左向右一次递增,但由于第二、五主族在电子排布时特使,是第二、五主族的元素的电离能较相邻两个主族元素的第一电离能大些,故C、N、O三种元素的第一电离能大小从大到小为N>O>C;
(2)根据丁二酮肟的结构可以得出,1mol丁二酮肟中含有15mol的σ键;其中碳原子存在sp2杂化和sp3杂化两种杂化方式;
(3)丁二酮肟镍是由两个丁二酮肟和一个镍构成,丁二酮肟镍中Ni与N原子之间以配位键形式存在,一个丁二酮肟中的O原子与另外一个丁二酮肟中的H原子以氢键形式存在,故答案为ac;
(4)Ni在晶胞中占有8个定点,故一个晶胞中含有![]() =1和Ni原子,Cu在晶胞中占有6个面心,故一个晶胞中含有
=1和Ni原子,Cu在晶胞中占有6个面心,故一个晶胞中含有![]() =3个Cu原子,故镍白铜的分子式为Cu3Ni。
=3个Cu原子,故镍白铜的分子式为Cu3Ni。


科目:高中化学 来源: 题型:
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
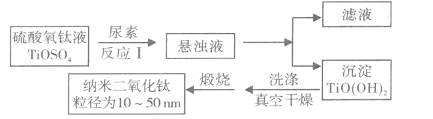
回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:
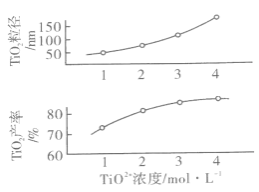
结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种短周期元素,随着原子序数的递增(横坐标),其原子半径相对大小、最高正价或最低负价的变化情况如图所示。
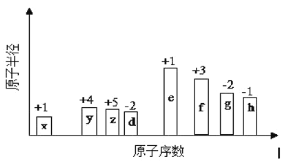
(1)元素h在周期表中的位置是____________。
(2)元素x和y形成的最简单化合物在家庭生活中的用途是____________。
(3)元素e、f最高价氧化物对应水化物的碱性强的是____________。(写化学式)
(4)元素z、x可形成原子个数比为1﹕3的化合物,其电子式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4的质量为98g·mol-1
B. H2SO4的摩尔质量为98g
C. 6.02×1022个H2SO4分子的质量为9.8g
D. 9.8 g H2SO4含有6.02×1023个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
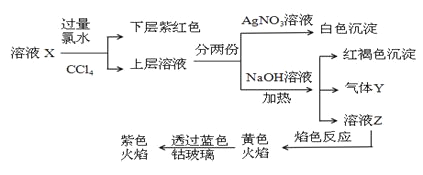
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是
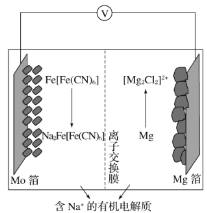
A.放电时,负极反应:2Mg-4e-+2Cl-=[Mg2Cl2]2+
B.充电时,Mg箔接电源的负极
C.放电时,Na+通过交换膜从左室移向右室
D.外电路中通过0.1mol电子的电量时,正极质量变化为2.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景。
(1)可用Pt/Al2O3、Pd/C、Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2(g)+CO(g)CH3OH(g) ΔH<0
①如表所列数据是各化学键的键能,该反应的ΔH=______(用含字母的代数式表示)。
化学键 | H-H | C≡O | C-H | C-O | O-H |
键能/(kJ/mol) | a | b | c | d | e |
②在一定条件下,将1 molCO和2 molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

X轴上a点的数值比b点_________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________。
(2)用CO2和H2合成甲醇:3H2(g) + CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
平衡数据 | c(CH3OH)/molL-1 | c1 | c2 | c3 |
反应的能量变化/kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
①甲容器20s达到平衡时测得x=29.4,则甲中平均反应速率v(CO2)=______。
②下列说法错误的是________(填字母编号)。
A.2c2<c3 B.z>2y C.p3<2p1 D.α1+α3=1
(3)甲醇与水蒸气重整可以制氢。已知:
甲醇分解反应:CH3OH(g)CO(g) + 2H2(g) ΔH1=+90.64 kJ·mol-1
水蒸气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.20 kJ·mol-1
①科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最大的反应方程式为______________。
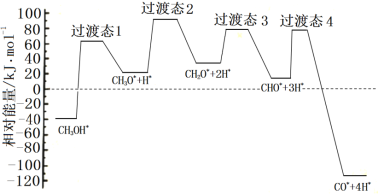
②573.2K时,向一刚性密闭容器中充入5.00MPaCH3OH使其分解,th后达平衡时容器中压强变为10.00MPa,其平衡常数分压Kp =_________。
③在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2 O)=1:1.3的混合气体充入一刚性密闭容器中反应。实验测得水煤气变换反应的速率随温度的升高明显下降,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
铜与浓硝酸可能发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸铜的物质的量为![]() =0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
=0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
【点睛】
考查化学方程式的计算。注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键。铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量。
【题型】单选题
【结束】
11
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.钢铁零件“发蓝”实质上是使铁表面钝化
B.上述反应中,铁被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反应中转移2mol电子,生成还原产物8.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子得到的电子数目等于碳原子失去的电子数目
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com