
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景。
(1)可用Pt/Al2O3、Pd/C、Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2(g)+CO(g)CH3OH(g) ΔH<0
①如表所列数据是各化学键的键能,该反应的ΔH=______(用含字母的代数式表示)。
化学键 | H-H | C≡O | C-H | C-O | O-H |
键能/(kJ/mol) | a | b | c | d | e |
②在一定条件下,将1 molCO和2 molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

X轴上a点的数值比b点_________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________。
(2)用CO2和H2合成甲醇:3H2(g) + CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
平衡数据 | c(CH3OH)/molL-1 | c1 | c2 | c3 |
反应的能量变化/kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
①甲容器20s达到平衡时测得x=29.4,则甲中平均反应速率v(CO2)=______。
②下列说法错误的是________(填字母编号)。
A.2c2<c3 B.z>2y C.p3<2p1 D.α1+α3=1
(3)甲醇与水蒸气重整可以制氢。已知:
甲醇分解反应:CH3OH(g)CO(g) + 2H2(g) ΔH1=+90.64 kJ·mol-1
水蒸气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.20 kJ·mol-1
①科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最大的反应方程式为______________。
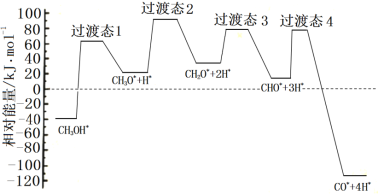
②573.2K时,向一刚性密闭容器中充入5.00MPaCH3OH使其分解,th后达平衡时容器中压强变为10.00MPa,其平衡常数分压Kp =_________。
③在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2 O)=1:1.3的混合气体充入一刚性密闭容器中反应。实验测得水煤气变换反应的速率随温度的升高明显下降,原因是______________。
【答案】(2a+b-3c-d-e)kJ·mol-1 小 随着Y值的增大,φ(CH3 OH)减小,平衡2H2(g)+CO(g)CH3OH(g)向逆反应方向进行,故Y为温度 0.015mol·L-1·s-1 BD CH3OH*==CH3O*+H* 25(MPa)2 随着温度升高,催化剂活性降低
【解析】
(2)分析题给条件,在恒温恒容条件下的等效平衡,通过“一边倒”的换算方法,可知甲乙为完全等效,此时物质的量浓度、物质的量、质量、分子数等都相同。丙的投入量为乙的两倍,可利用虚拟“中间态”法构建等效平衡,即新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强,结合可逆反应的平衡移动,进行分析。
(3)②压强平衡常数的计算类似化学平衡常数,根据平衡常数计算公式将分压代入计算。
(1)①由反应热ΔH=反应物的总键能-生成物总键能进行计算。则有:ΔH=(2a+b-3c-d-e)kJ·mol-1;答案为:(2a+b-3c-d-e)kJ·mol-1;
②根据图像得出X轴上a点的数值比b点小,某同学认为上图中Y轴表示温度,其判断的理由是随着Y值的增大,φ(CH3OH)减小,反应2H2(g)+CO(g)CH3OH(g)向逆反应方向进行,故Y为温度;答案为:小;随着Y值的增大,φ(CH3OH)减小,反应2H2(g)+CO(g)CH3OH(g)向逆反应方向进行,故Y为温度;
(2)①根据3H2(g)+CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1,20s达到平衡时测得x=29.4,可知消耗的CO2的量为![]() ,则可知v(CO2)=
,则可知v(CO2)=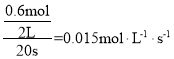 ;答案为:0.015mol·L-1·s-1;
;答案为:0.015mol·L-1·s-1;
②A.已知甲和乙为全等等效平衡,平衡时c1=c2,乙和丙的投料比相等,若处于恒压时,c2= c3*,c3*为恒压时丙中甲醇浓度,此时,丙是乙体积的两倍,但题目要求恒容,因而可将丙压缩一半体积,瞬间浓度为2c3*,由于压缩体积相当于加压,根据气体计量数可知,平衡向右移动,则甲醇浓度变大,因而c3>2c3*,综上分析可知c3>2c2,A项正确
B.乙和丙的投料比相等,假设在恒压时,c2= c3*,c3*为恒压时丙中甲醇浓度,由于丙是乙体积的两倍,丙中甲醇的消耗量是乙的两倍,可推出吸收的热量关系为z*=2y(注意乙和丙为逆反应,为吸热反应),z*为恒压式丙中热量变化,但题目要求恒容,因此可将丙压缩一半体积,由于压缩体积相当于加压,根据气体计量数可知,平衡向右移动,则甲醇的量变多,及吸收的热量减少,即z<z*,故z<2y,B项错误;
C.根据B中分析可知平衡时,丙中甲醇的消耗量是小于乙中甲醇的消耗量的两倍,由于恒温恒容时压强之比等于无知的量之比,因而可知丙中气体压强小于乙中气体的两倍,因此p3<2p2,而甲和乙为全等等效平衡,可知p1=p2,则p3<2p1,C项正确;
D.已知甲和乙为全等等效平衡,平衡时c1=c2,甲中![]() ,乙中
,乙中![]() ,因而α1+α2=2c1+1-2c2=1,平衡时,丙中甲醇的消耗量是小于乙中甲醇的消耗量的两倍,因而α3小于α2,所以α1+α3<1,D项错误;
,因而α1+α2=2c1+1-2c2=1,平衡时,丙中甲醇的消耗量是小于乙中甲醇的消耗量的两倍,因而α3小于α2,所以α1+α3<1,D项错误;
答案选BD;答案为:BD;
(3)①由图可知,此历程中活化能最大的反应方程式为CH3OH*==CH3O*+H*;答案为:CH3OH*==CH3O*+H*;
②假设CH3OH的压强变化量为x,则:
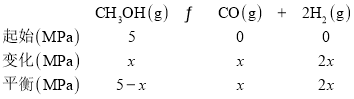
根据题意有:![]() ,x=2.5MPa
,x=2.5MPa
则Kp=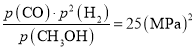 ,答案为:25(MPa)2;
,答案为:25(MPa)2;
③将甲醇分解反应热化学方程式与水蒸气变换反应的热化学方程式相加,可得:
CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH3=+90.64 kJ·mol-1–41.20 kJ·mol-


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
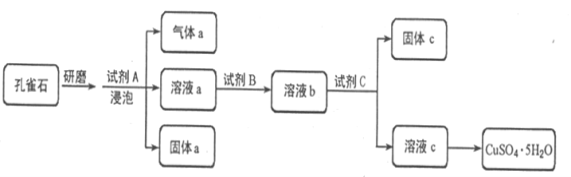
(1)研磨孔雀石的目的是________________________________________。
(2)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最宜选用_______(填字母)。
A 酸性KMnO4溶液 B 双氧水 C 浓硝酸 D 新制氯水
相应的离子方程式是______________。
(3)使用试剂C的目的是调节溶液的pH,使Fe3+转化为沉淀以便分离,试剂C宜选用__________(填字母)。A 稀硫酸 B NaOH溶液 C 氨水 D CuO
(4)常温下Fe(OH)3的Ksp = 4×10-38,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,将溶液的pH调节至4。则此时c(Fe3+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
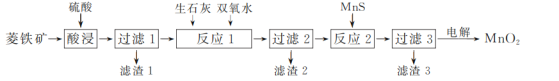
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
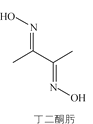
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
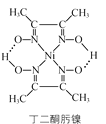
a.配位键 b. 离子键 c. 氢键 d. 范德华力
(4)某镍白铜的晶胞如图所示,其化学式为________。
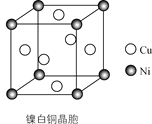
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O
C.向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.Al2O3溶于NaOH溶液:Al2O3+2OH-=2AlO2-+2H2O
B.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
C.用惰性电极电解0.1mol·L-1CuCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D.过量NaHCO3溶液和澄清石灰水混合:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的ΔH>0,ΔS<0
B.常温下,将稀CH3COOH溶液加水稀释,溶液中![]() 的值不变
的值不变
C.在铜的精炼过程中,若转移1mol电子,则阴极析出Cu的质量为32g
D.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则其热化学方程式为N2(g)+3H2(g)=2NH3(g);ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物是指分子中两个环共用一个碳原子的化合物。甲、乙、丙三种有机物的结构如图所示。
甲: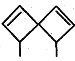 乙:
乙: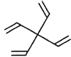 丙:
丙: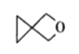
下列说法中正确的是
A.甲、乙、丙都属于螺环化合物
B.丙是环氧乙烷(![]() )的同系物
)的同系物
C.甲、乙互为同分异构体
D.甲、乙、丙分子中所有碳原子均处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com