
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______对自旋方向相反的电子。
(2)丙酮(![]() )分子中,中间碳原子的杂化方式为______;
)分子中,中间碳原子的杂化方式为______;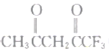 中
中![]() 键和π键的数目之比为__________________.
键和π键的数目之比为__________________.
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体;Fe3+的核外电子排布式为__________________。
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________。分子中的大π键用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则CO32-中的大π键应表示为____________。
),则CO32-中的大π键应表示为____________。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
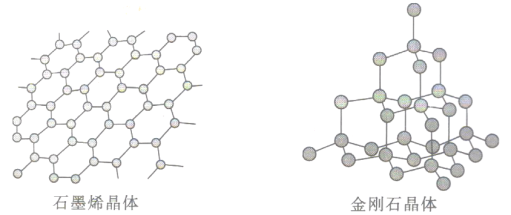
①在石墨烯晶体中,一个六元环上的C原子数为__________________。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有_______个C原子在同一平面。
【答案】2 sp2 7:1 CS2、SCN-等 分子 1s22s22p63s23p63d5 Ca2+的半径小于Ba2+,更容易结合CO32-中O2-,因此CaCO3更容易分解 ![]() 2 12 4
2 12 4
【解析】
(1)C原子的核外有6个电子,电子排布式为1s22s2p2,其中1s、2s上的2对电子的自旋方向相反,而2p轨道上的电子自旋方向相同,所以核外存在2对自旋方向相反的电子;
(2)丙酮分子中中间碳原子形成碳氧双键,为sp2杂化;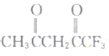 分子中每个碳氧双键中各有一个π键,其他化学键均为
分子中每个碳氧双键中各有一个π键,其他化学键均为![]() 键,共14个,所以
键,共14个,所以![]() 键和π键的数目之比为7:1;
键和π键的数目之比为7:1;
(3)O与S同主族,所以与CO2具有相同空间结构的分子为CS2;等电子体具有相同的空间结构,与CO2互为等电子的离子有SCN-;
(4)Fe(CO)5的熔点为253K,沸点为376K,熔沸点较低,所以为分子晶体;Fe为26号元素,根据电子排布规律可知基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去外层3个电子后形成Fe3+,所以其核外电子排布为1s22s22p63s23p63d5;
(5)Ca2+的半径小于Ba2+,更容易结合CO32-中O2-,因此CaCO3更容易分解;CO32-中心原子价层电子对数为![]() ,因此CO32-的空间构型为平面三角形,C原子、O原子有平行的p轨道,价电子总数为4+2+6×3=24,每个O原子有2对孤电子对未参与成键,所以单电子数=24-2×3-4×3=6,所以CO32-为4原子、6电子形成的大π键,表示为
,因此CO32-的空间构型为平面三角形,C原子、O原子有平行的p轨道,价电子总数为4+2+6×3=24,每个O原子有2对孤电子对未参与成键,所以单电子数=24-2×3-4×3=6,所以CO32-为4原子、6电子形成的大π键,表示为![]() ;
;
(6)①根据均摊法,石墨烯中每个C原子被3个六元环共有,则每个六元环占有的C原子数为![]() =2;
=2;
②每个C原子周围形成4个共价键,可以组合6个角,每个角延伸为两个六元环,因此每个C原子连接有2×6= 12个六元环;根据几何知识,六元环中最多有4个C原子共面,如图所示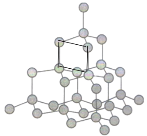 。
。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式如图所示,下列关于邻二乙烯苯的说法不正确的是
A.1 mol邻二乙烯苯含有5 mol碳碳双键
B.所有的原子可能在同一平面
C.能发生加成反应,也能发生取代反应
D.苯环上的二氯代物有4种(不考虑立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氮俗称笑气,是一种氧化剂,也可以用来作为火箭和赛车的氧化剂。值得注意的是,N2O是一种强大的温室气体,它的效果是二氧化碳的296倍,因此研究其分解对环境保护有着重要意义。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为______________。
(2)已知反应2N2O(g)![]() 2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
(3)碘蒸气存在能大幅度提高2N2O(g)![]() 2N2(g)+O2(g)的分解速率,反应历程为:
2N2(g)+O2(g)的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步________________________(慢反应)
第三步IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
第二步反应方程式为__________________________________,活化能最大的是第____步反应。
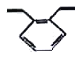
(4)T℃下将N2O充入5L的刚性容器中,发生反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如图:
2N2(g)+O2(g)的部分实验数据如图:
①T℃该反应的平衡常数值为________________,100min 时,向容器中加入0.1mol N2O和0.9mol N2,此时平衡________________(填“向正反应方向移动、向逆反应方向移动、不移动”)。
②半衰期是指任一浓度N2O消耗一半时所需的相应时间。N2O从某一浓度到另一浓度需要时间t可表示为![]() 其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将无机碳转化为有机化合物是目前研究的热点,也是减少CO2和CO的有效措施之一,对环境的保护起到了积极作用。
I.二氧化碳催化加氢甲烷化工艺是利用氨还原CO2,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(l)H1。
CH4(g)+2H2O(l)H1。
(1)已知:H2(g)的燃烧热H2=-285.8kJ·mol-1,CH4(g)的燃烧热H=-890.3kJ·mol-1,则△H1=________kJ·mol-1。
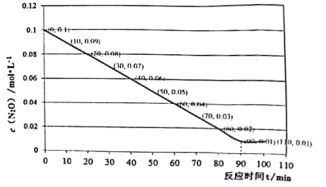
(2)测得该反应的吉布斯自由能(G=H-TS)随温度的变化曲线如图甲所示,为使CO2顺利转化为CH4,反应应在___下进行。
II.一氧化碳催化加氢制甲醇:CO(g)+2H2(g)![]() CH2OH(g)。
CH2OH(g)。
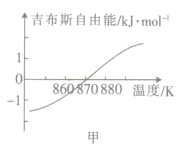
(3)图乙是反应中部分物质的浓度随时间t的变化情况,0~10min内,用H2表示的平均反应速率v(H2)=_____,该反应平衡常数的表达式为_______________。
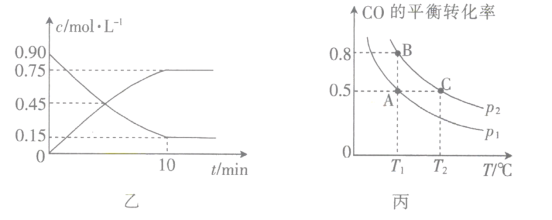
(4)在容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图丙所示。
①p1______(填“>”“<”或“=”)p2。
②比较图丙中A、C两点,平衡常数KA__________(填“>”“<”或“=")KC。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数KA=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是( )
2HI(g)达到平衡状态时的标志是( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大环多醚称为冠醚。二苯并-18-冠-6的结构简式如图所示。下列说法不正确的是
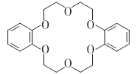
A.该有机物的分子式为C20H24O6
B.该有机物中所有原子不可能共平面
C.在光照下,该有机物与氯气反应的一氯代物有4种(不考虑立体异构)
D.1 mol该有机物的苯环最多可与6 mol H2发生加成反应(不考虑开环加成)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
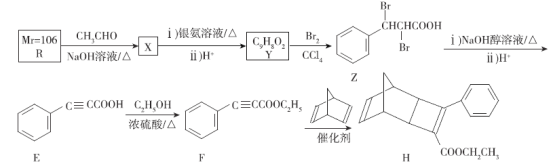
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用排饱和食盐水法先后收集20mL甲烷和80mL氯气,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。回答下列问题:
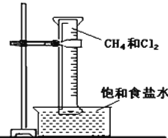
(1)大约30min后,可以观察到量筒内壁出现___________状液体,量筒内液面___________(填“上升”、“下降”或“不变”)。
(2)使1mol甲烷和氯气发生取代反应,生成相同物质的量的四种有机取代物,则需要氯气的物质的量是___________,写出其中常作为有机溶剂和灭火剂的物质的电子式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com