
分析 (1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(2)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(3)根据反应后为不溶物和溶液两部分,要得到干燥固体需要的实验操作解答;
(4)根据Mg、Al都能够与氧气化学反应生成氧化物分析还需要知道的数据;
(5)设出金属镁和铝的物质的量,根据合金的质量和灼烧后的质量列式计算出镁的物质的量,再计算出镁的质量分数;
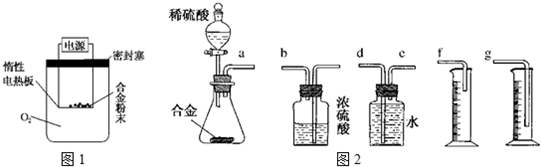
(6)根据装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出进行排序.
解答 解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑
54g 2mol
5.4g×97% V×10-3L×2.0mol/L
54g:(5.4g×97%)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL,
故答案为:97;
(3)反应后金属铝完全消耗,没有反应的为金属镁,称量金属镁之前需要经过过滤、洗涤、干燥操作,然后再称量固体质量,从而计算出合金中镁的含量,
故答案为:过滤、洗涤、干燥固体;
(4)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,
故答案为:灼烧后固体的质量;
(5)设xg铝镁合金粉末中含有n mol镁、zmol铝,则24n+27z=x①,
再根据反应关系式:Mg~MgO、Al~Al2O3,最后得到了yg氧化物,据此列式为:40n+51z=y②,
根据①②解得:z=$\frac{3y-5x}{18}$mol,铝的质量为:27g/mol×$\frac{3y-5x}{18}$mol=$\frac{9y-15x}{2}$g,合金中镁的质量分数为$\frac{x-\frac{9y-15x}{2}}{x}$=$\frac{17x-9y}{2x}$,
故答案为:$\frac{17x-9y}{2x}$;
(6)装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为a接e、d接g,
故答案为:e、d接g.
点评 本题考查物质含量的测定,为高频考点,理解实验原理是解题的关键,是对知识的综合考查,要求学生具有扎实的基础及综合运用知识分析问题、解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
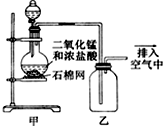
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KClO3或KMnO4 | |
| C. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 | |
| D. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
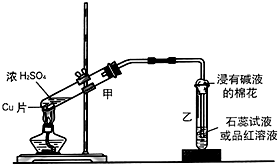 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com