
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
分析 A.酸性氧化物是和碱反应生成盐和水反应生成盐和水的氧化物;
B.微粒直径在1-100nm的分散质形成的分散系为胶体;
C.水溶液中或熔融状态下导电的化合物为电解质;
D.不同物质组成的为混合物;
解答 解:A.SO2、SiO2和碱反应生成盐和水的氧化物为酸性氧化物,CO不能和碱反应属于不成盐氧化物,故A错误;
B.稀豆浆、硅酸均为胶体,氯化铁溶液不是胶体,故B错误;
C.烧碱是氢氧化钠、纯碱是碳酸钠都是电解质,石英是二氧化硅,本身不能电离出离子是非电解质,故C错误;
D.氯水是氯气的水溶液、水玻璃是硅酸钠水溶液、氨水是氨气的水溶液,都是不同物质组成的均为混合物,故D正确;
故选D.
点评 本题考查了物质分类、物质组成、物质性质和胶体组成的分析等知识,掌握基础是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
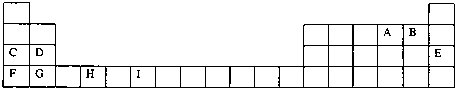
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
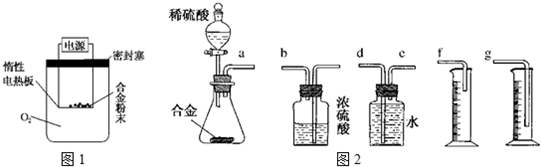
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 动物皮革的主要成分是蛋白质,且天然蛋白质水解的最终产物是氨基酸 | |
| C. | 苯和乙烯都可以与溴的四氯化碳溶液反应而使之褪色 | |
| D. | 石油分馏可获得乙酸,苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
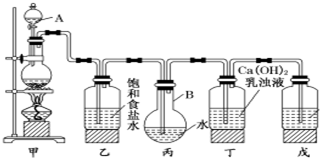
 工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
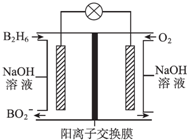 乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )
乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )| A. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池工作时,Na+通过阳离子交换膜向右移动 | |
| C. | 转移6mol电子理论上消耗乙硼烷的质量为14g | |
| D. | 消耗1mol B2H6时负极参与反应的n(OH-)为12mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com