
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
【答案】C
【解析】A、CuCl2和Na2S发生CuCl2+Na2S=CuS↓+2NaCl,b点时两者恰好完全反应,a点时CuCl2过量,CuCl2属于强酸弱碱盐,Cu2+水解,促进水的电离,c点时Na2S过量,S2-水解,促进水的电离,因此水的电离程度最大的不是b点,故A错误;B、根据质子守恒,则有c(H+)+c(HS-)+2c(H2S)=c(OH-),故B错误;C、CuS(s) ![]() Cu2+(aq)-+S2-(aq),在b点时c(Cu2+)=c(S2-)=10-17.7,Ksp(Cu2S)=10-17.7×10-17.7=10-35.4,已知lg2=0.3,
Cu2+(aq)-+S2-(aq),在b点时c(Cu2+)=c(S2-)=10-17.7,Ksp(Cu2S)=10-17.7×10-17.7=10-35.4,已知lg2=0.3,
Ksp(CuS)=(10-0.3)2×10-36=4×10-36 mol2/L2,故C正确;D、Zn2+出现沉淀,需要c(S2-)=Ksp(ZnS)/c(Zn2+)=3×10-25/10-5mol·L-1=3×10-20mol·L-1,Cu2+出现沉淀,需要c(S2-)= Ksp(CuS)/c(Cu2+)=4×10-36/10-5mol·L-1=4×10-31mol·L-1,因此Cu2+先沉淀,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学做如下实验:
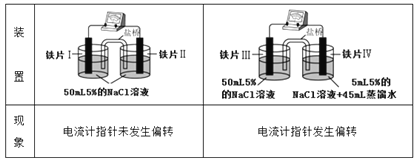
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
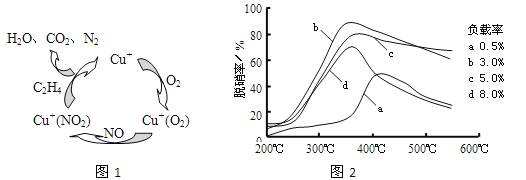
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
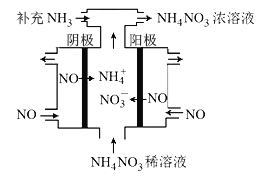
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,不能说明乙酸是弱电解质的是
A. 常温时,测得乙酸钠溶液的pH>7
B. 常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C. 乙酸溶液与大理石反应产生气泡
D. 相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)。
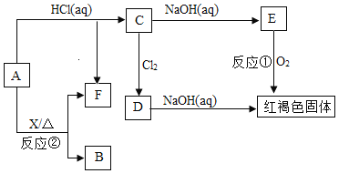
请根据以上信息回答下列问题:
(1)写出物质B的化学式:________。
(2)写出下列反应的化学方程式:
反应①______________________________________。
反应②_______________________________________。
(3)写出下列反应的离子方程式:反应C→D________________________。
(4)检验D中阳离子的方法:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com