
分析 (1)达到化学平衡后,测的反应器中有0.04mol SO3(g),则
2SO2(g)+O2(g)?2SO3(g)
始(mol•L-1) 0.025 0.015 0
转(mol•L-1) 0.02 0.01 0.02
平衡(mol•L-1) 0.005 0.005 0.02
结合K为生成物浓度幂之积与反应物浓度幂之积的比、转化率=$\frac{转化的量}{开始的量}$×100%计算;
(2)结合平衡的特征“等、定”及衍生的物理量判定平衡状态.
解答 解:(1)达到化学平衡后,测的反应器中有0.04mol SO3(g),则
2SO2(g)+O2(g)?2SO3(g)
始(mol•L-1) 0.025 0.015 0
转(mol•L-1) 0.02 0.01 0.02
平衡(mol•L-1) 0.005 0.005 0.02
K=$\frac{(0.02)^{2}}{(0.005)^{2}×0.005}$=3200 L/mol,
SO2的平衡转化率为$\frac{0.02}{0.025}$×100%=80%,
答:反应的平衡常数为3200 L/mol,平衡时SO2的平衡转化率为80%;
(2)a.V(O2)正=2V(SO3)逆,则$\frac{V({O}_{2})正}{V(S{O}_{3})逆}$=$\frac{2}{1}$,不等于化学计量数之比,则不是平衡状态,故a不选;
b.容器中O2的质量不随时间而变化,符合平衡特征“定”,为平衡状态,故b选;
c.气体的质量、体积均不变,容器中气体的密度始终不随时间而变化,不能判定平衡状态,故c不选;
d.该反应为气体物质的量前后不等的反应,容器中气体的分子总数不随时间而变化,符合平衡特征“定”,为平衡状态,故d选;
故答案为:bd.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算、平衡判定为解答的关键,侧重分析与应用能力的考查,注意利用平衡浓度计算K,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
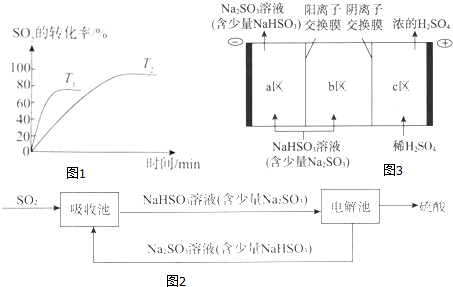
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.| 共价键 | H-H | N-H | N=N |
| 键能/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3质量分数17%的氨水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 40 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com