
【题目】甲、乙两同学分别设计实验,测定CO2与Na2O2反应后的残留物(成分为Na2O2、Na2CO3及少量不溶性杂质)中Na2O2的质量分数。
(1)甲同学设计的实验流程如下:
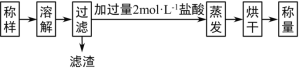
①试样溶解过程中发生反应的化学方程式为_______。
②实验中用12 molL-1盐酸配制2molL-1盐酸500mL,配制过程中用到的仪器有烧杯、玻璃棒、_____、______、_______,定容时俯视刻度线会使所配溶液浓度_____(填“偏高”“偏低”或“无影响”)。
③称取试样5.12 g,得滤渣0.10g,烘干得固体5.85g,则试样中Na2O2的质量分数为___________%(保留1位小数)。
(2)乙同学利用如图所示装置进行实验。

①实验中应选取的试剂是_______________。
a 稀盐酸 b 二氧化锰 c 蒸馏水 d 碳酸钙
②装置的连接顺序应是_______________________(填各接口的字母,连接胶管略)。
【答案】2Na2O2+2H2O = 4NaOH+O2↑ 100mL量筒 500mL容量瓶 胶头滴管 偏高 15.2 c DBAC
【解析】
(1)由流程可知,称样、溶解后,过滤分离出不溶性物质,加盐酸反应生成氯化钠,蒸发、烘干、称量得到NaCl的质量,结合钠原子守恒计算;
(2)图2中利用测定氧气的体积计算过氧化钠的含量,分液漏斗中试剂为水,排水法测定氧气的体积,以此来解答。
(1)①试样溶解过程中式样中过氧化钠会与水发生反应,化学方程式为2Na2O2+2H2O═4NaOH+O2↑;
②用12 molL﹣1盐酸配制2molL﹣1盐酸500mL,浓盐酸的体积为![]() =0.083L=83mL,配制过程中用到的仪器有烧杯、玻璃棒、100mL量筒、500mL容量瓶、胶头滴管;定容时俯视刻度线,V偏小,会使所配溶液浓度偏高;
=0.083L=83mL,配制过程中用到的仪器有烧杯、玻璃棒、100mL量筒、500mL容量瓶、胶头滴管;定容时俯视刻度线,V偏小,会使所配溶液浓度偏高;
③加入过量盐酸后溶液Na元素的存在形式只有NaCl,烘干工程中过量的盐酸会挥发掉,所以烘干得到的固体为NaCl;设混合物中Na2O2、Na2CO3的物质的量分别为x、y,则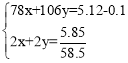 ,解得x=0.01mol,试样中Na2O2的质量分数为
,解得x=0.01mol,试样中Na2O2的质量分数为![]() ×100%=15.2%;
×100%=15.2%;
(2)①本实验的目的是要通过生成的氧气的量来确定过氧化钠的量,为了保证生成的气体只有氧气,可选用蒸馏水,碳酸钠与盐酸反应会生成二氧化碳气体影响结果;
②集气瓶中装满水,排水法测定氧气的体积,排水时导管短进长出,则接顺序应是DBAC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式________________.
(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).
(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列叙述错误的是
A.10g质量分数为46%的乙醇溶液中含有的氢原子数为0.6NA
B.28g乙烯和丙烯的混合气体中含有的碳原子数为2NA
C.2.0gD2O中含有的质子数、电子数均为NA
D.在密闭容器中2molSO2和1molO2充分反应后,容器中含有的原子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ![]()
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g) ![]()
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l) ![]()
b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) ![]()
则总反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的![]() =_____________。
=_____________。
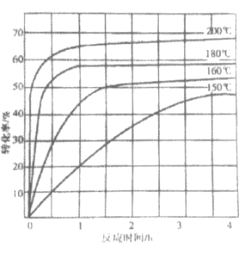
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________。
③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Q、X、Y、Z的原子序数逐渐增大,Q的单质是空气的主要成分之一,X与Q同周期,且X是该周期中非金属性最强的元素,Y、Z原子的最外层电子数之和为10,Y与Z形成的某种阴离子的结构如图所示.下列说法正确的是
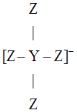
A.X、Z的简单氢化物的水溶液均为强酸
B.Y的单质在常温下性质稳定,不与强酸、强碱反应
C.Y与Z形成的化合物可用作高温结构陶瓷材料
D.简单氢化物的稳定性:Q<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着现代科学技术的快速发展,防腐蚀技术也在不断提高。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为________。
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)________(填“增大”、“不变”或“减小”)。
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。
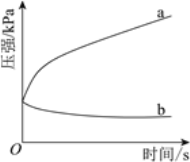
图中代表pH=2的曲线是________(填“a”或“b”)。
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是________。
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为______;同时,MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出MoO42-与Fe2+反应的离子反应方程式:_______。
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备纳米Al2O3、AlCl3·6H2O及铵明矾晶体(NH4Al(SO4)212H2O,摩尔质量为453gmol-1),具体流程如图:
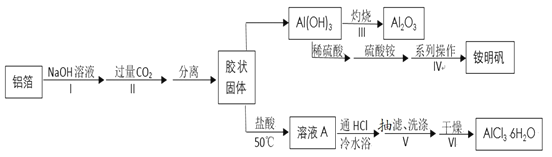
已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)步骤Ⅰ的离子方程式为______。
(2)下列操作或描述正确的是_____。
A.步骤IV制备铵明矾利用了物质的溶解度差异
B.步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重
C.步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌
D.步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃
(3)由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是______(写两条)。
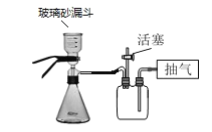
(4)步骤V抽滤时不能用滤纸,原因是_____。若用如图装置图进行抽滤,则抽滤结束时应进行的操作是______。
(5)用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,以钛铁矿(主要成分是FeTiO3,还含有少量Fe2O3)为原料制备钛的流程如下:
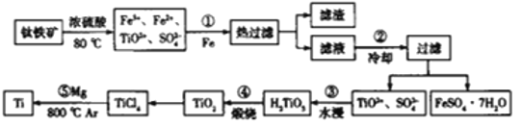
(1)FeTiO3中Ti的化合价为_______________________.
(2)步骤①中加Fe的目的是_____________________(用离子方程式表示).
(3)步骤②冷却的目的是______________________________________________.
(4)水浸过程发生的反应为TiO2++2H2O=H2TiO3↓+2H+,从成本或废物的再利用因素考虑,水浸后废液中应加入____________________处理.
(5)写出步骤⑤的化学方程式:____________________________,该反应在Ar气氛中进行的目的是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
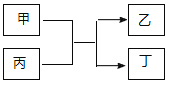
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com