
【题目】某兴趣小组用铝箔制备纳米Al2O3、AlCl3·6H2O及铵明矾晶体(NH4Al(SO4)212H2O,摩尔质量为453gmol-1),具体流程如图:
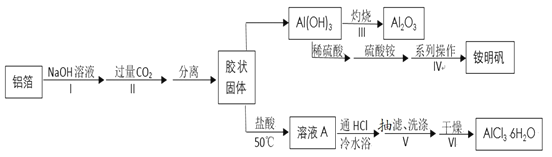
已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)步骤Ⅰ的离子方程式为______。
(2)下列操作或描述正确的是_____。
A.步骤IV制备铵明矾利用了物质的溶解度差异
B.步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重
C.步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌
D.步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃
(3)由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是______(写两条)。
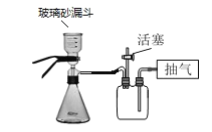
(4)步骤V抽滤时不能用滤纸,原因是_____。若用如图装置图进行抽滤,则抽滤结束时应进行的操作是______。
(5)用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ AD 抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成 溶液呈酸性会腐蚀滤纸 先打开安全瓶上的活塞,再关闭抽气泵,最后取下玻璃砂漏斗 95.20%
【解析】
Al和NaOH溶液反应得到NaAlO2,NaAlO2溶液通入过量CO2得到Al(OH)3胶状沉淀,过滤除去滤液得到Al(OH)3胶状固体,Al(OH)3受热分解得到Al2O3。Al(OH)3和硫酸反应得硫酸铝,硫酸铝和硫酸铵混合后根据溶解度差异析出硫酸铝铵,经过滤、洗涤、干燥得铵明矾晶体[NH4Al(SO4)212H2O]。Al(OH)3和HCl反应得AlCl3溶液,为抑制AlCl3水解,在AlCl3溶液中通入HCl后抽滤、洗涤、干燥得AlCl3·6H2O,据此解答。
(1)步骤Ⅰ为Al和NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)A.步骤IV中,只有NH4Al(SO4)2溶解度比硫酸铵、硫酸铝小,才能析出硫酸铝铵晶体,A正确;
B.灼烧在坩埚中而不是蒸发皿中进行,B错误;
C.氢氧化铝能形成胶体,沉淀颗粒非常微小,抽滤的话,胶粒会穿透滤纸造成损失,用玻璃棒搅拌可能造成滤纸破损,氢氧化铝损失更严重,C错误;
D.铵明矾可溶于水、不溶于乙醇,故用乙醇洗涤,高于120℃时铵明矾失去结晶水,故温度应低于120℃,D正确;
答案选AD;
(3)氯化铝会水解:AlCl3+3H2O![]() Al(OH)3+3HCl,通入HCl气体可抑制氯化铝水解。同时:AlCl36H2O(s)
Al(OH)3+3HCl,通入HCl气体可抑制氯化铝水解。同时:AlCl36H2O(s)![]() Al3+(aq)+3Cl-(aq)+6H2O(l),增大Cl-的浓度,有利于AlCl36H2O晶体形成,故答案为:抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成;
Al3+(aq)+3Cl-(aq)+6H2O(l),增大Cl-的浓度,有利于AlCl36H2O晶体形成,故答案为:抑制氯化铝的水解;增大Cl-的浓度,有利于AlCl36H2O晶体形成;
(4)AlCl3溶液显酸性,会腐蚀滤纸,故步骤V抽滤时不能用滤纸,可用玻璃砂漏斗,抽滤结束时,应先打开活塞恢复常压,然后关闭抽气泵,最后取下玻璃砂漏斗,故答案为:溶液呈酸性会腐蚀滤纸;先打开安全瓶上的活塞,再关闭抽气泵,最后取下玻璃砂漏斗;
(5)样品平均分成2份,第一份中:n(Al3+)=0.002900mol,第二份中:n(SO42-)=0.006300mol, n(SO42-)>2n(Al3+),则每份中:n[NH4Al(SO4)212H2O]=n(Al3+)=0.002900mol,m[NH4Al(SO4)212H2O]=0.002900mol×453gmol-1=1.3137g,故样品中铵明矾的纯度=![]() ≈95.20%,故答案为:95.20%。
≈95.20%,故答案为:95.20%。


科目:高中化学 来源: 题型:
【题目】如图所示,在A处通入未经干燥的氯气。当关闭B阀时C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是( )
①饱和NaCl溶液②NaOH溶液③H2O④浓硫酸
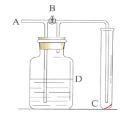
A.①B.①③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:
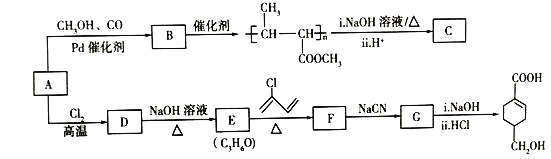
已知:①![]() +
+![]() Δ
Δ![]() ;②R-C≡N
;②R-C≡N![]() R-COOH。
R-COOH。
回答下列问题:
(1)A的名称是________
(2)C的结构简式为_______
(3)![]() 发生缩聚反应的有机产物的结构简式为________。
发生缩聚反应的有机产物的结构简式为________。
(4)E→F的化学方程式为_______.
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是________(写结构简式)。
(6)写出用苯乙烯![]() 为原料制备化合物
为原料制备化合物![]() 的合成线路,其他无机试剂任选______。
的合成线路,其他无机试剂任选______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学分别设计实验,测定CO2与Na2O2反应后的残留物(成分为Na2O2、Na2CO3及少量不溶性杂质)中Na2O2的质量分数。
(1)甲同学设计的实验流程如下:
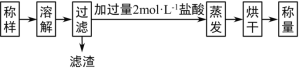
①试样溶解过程中发生反应的化学方程式为_______。
②实验中用12 molL-1盐酸配制2molL-1盐酸500mL,配制过程中用到的仪器有烧杯、玻璃棒、_____、______、_______,定容时俯视刻度线会使所配溶液浓度_____(填“偏高”“偏低”或“无影响”)。
③称取试样5.12 g,得滤渣0.10g,烘干得固体5.85g,则试样中Na2O2的质量分数为___________%(保留1位小数)。
(2)乙同学利用如图所示装置进行实验。

①实验中应选取的试剂是_______________。
a 稀盐酸 b 二氧化锰 c 蒸馏水 d 碳酸钙
②装置的连接顺序应是_______________________(填各接口的字母,连接胶管略)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
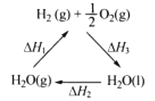
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
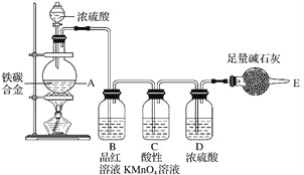
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;
②__。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式__。
(3)B中的现象是__,C的作用是__。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为__(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:__。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com