
����Ŀ��A��C3H6���ǻ����л�����ԭ�ϡ���A�Ʊ��ۺ���C��![]() �ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
�ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
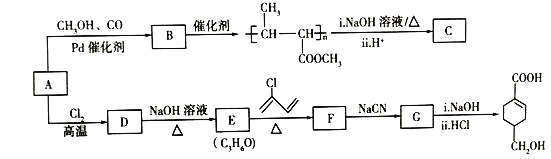
��֪����![]() +
+![]() ��
��![]() ����R-C��N
����R-C��N![]() R-COOH��
R-COOH��
�ش��������⣺
��1��A��������________
��2��C�Ľṹ��ʽΪ_______
��3��![]() �������۷�Ӧ���л�����Ľṹ��ʽΪ________��
�������۷�Ӧ���л�����Ľṹ��ʽΪ________��
��4��E��F�Ļ�ѧ����ʽΪ_______.
��5��B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ�Ĺ���________�֣����к˴Ź�������Ϊ3��壬�ҷ����֮��Ϊ6��1��1����________��д�ṹ��ʽ����
��6��д���ñ���ϩ![]() Ϊԭ���Ʊ�������
Ϊԭ���Ʊ�������![]() �ĺϳ���·���������Լ���ѡ______��
�ĺϳ���·���������Լ���ѡ______��
���𰸡���ϩ(��1-��ϩ) 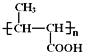
![]()
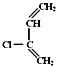 +
+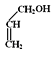
![]()
![]() 8
8 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��������
B�����Ӿ۷�Ӧ���ɾ۶�ϩ���������B�ṹ��ʽΪCH3CH=CHCOOCH3��AΪC3H6��A�����ӳɷ�Ӧ����B����A�ṹ��ʽΪCH2=CHCH3���۶�ϩ���������ˮ�ⷴӦȻ���ữ�õ��ۺ���C��C�ṹ��ʽΪ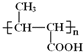 ��A������Ӧ����D��D����ˮ�ⷴӦ����E��E�ܷ��������Ϣ�ļӳɷ�Ӧ�����E����ʽ֪��E�ṹ��ʽΪCH2=CHCH2OH��D�ṹ��ʽΪCH2=CHCH2Cl��E��2-��-1��3-����ϩ�����ӳɷ�Ӧ����F��F�ṹ��ʽΪ
��A������Ӧ����D��D����ˮ�ⷴӦ����E��E�ܷ��������Ϣ�ļӳɷ�Ӧ�����E����ʽ֪��E�ṹ��ʽΪCH2=CHCH2OH��D�ṹ��ʽΪCH2=CHCH2Cl��E��2-��-1��3-����ϩ�����ӳɷ�Ӧ����F��F�ṹ��ʽΪ![]() ��F����ȡ����Ӧ����G��G������Ϣ�з�Ӧ�õ�
��F����ȡ����Ӧ����G��G������Ϣ�з�Ӧ�õ�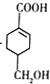 ����G�ṹ��ʽΪ
����G�ṹ��ʽΪ![]() ���ݴ˷������
���ݴ˷������
(1)���ݷ�����AΪC3H6��A�������DZ�ϩ(��1-��ϩ)��
(2)���ݷ�����C�Ľṹ��ʽΪ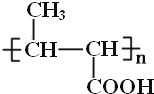 ��
��
(3)![]() �������۷�Ӧ���л�����Ľṹ��ʽΪ
�������۷�Ӧ���л�����Ľṹ��ʽΪ![]() ;
;
(4)E�ṹ��ʽΪCH2=CHCH2OH��F�ṹ��ʽΪ![]() ��E�����ӳɷ�Ӧ����F���÷�Ӧ����ʽΪ
��E�����ӳɷ�Ӧ����F���÷�Ӧ����ʽΪ +
+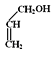
![]()
![]() ��
��
(5)B�ṹ��ʽΪCH3CH=CHCOOCH3��B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ��˵������̼̼˫����������ȩ����Ϊ������������������ͬ���칹����HCOOCH=CHCH2CH3��HCOOCH2CH=CHCH3��HCOOCH2CH2CH=CH2��HCOOC(CH3)=CHCH3��HCOOCH=C(CH3)2��HCOOC(CH3)CH=CH2��HCOOCHC(CH3)=CH2��HCOOCH(CH2CH3)=CH2�����Է�����������8�֣����к˴Ź�������Ϊ3��壬�ҷ����֮��Ϊ6��1��1����![]() ��
��
(6)��������ϳ����̣��ñ���ϩ![]() Ϊԭ���Ʊ�������
Ϊԭ���Ʊ�������![]() �ĺϳ���·Ϊ��
�ĺϳ���·Ϊ��![]()
![]()
![]()
![]()
![]()
![]()
![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���һ��ȼ�ϵ��(��ͼ��ʾ)��Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����

����Ҫ��ش�������⣺
��1����װ���У�ͨ�������ĵ缫Ϊ________(�������������)���ü��缫��ӦʽΪ________������KOH��Һ����������Һ���������缫��ӦʽΪ__________________________��
��2��������װ�ã�����˵����ȷ����________(�����)��
����Һ��Na����C���ƶ�
�ڴ�C�����ݳ���������ʹʪ���KI������ֽ����
�۷�Ӧһ��ʱ���ͨ������HCl�ɻָ������ǰ����ʵ�Ũ��
������״����Fe������2.24L���壬����Һ��ת��0.2mol����
��װ���з������ܷ�Ӧ�����ӷ���ʽΪ__________________________��
��3����װ���У�XΪ�����ӽ���Ĥ����Ӧһ��ʱ���Ĥ�����Һ��pH____(���������С�����䡱)�����ñ���MgCl2��Һ���汥���Ȼ�����Һ�����װ���з������ܷ�Ӧ______(��ı䡱���䡱)��
��4�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�________(�������С�����䡱)����ͭ�缫�ϵĵ缫��ӦʽΪ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ŷ����Ƴ���TM��LiH��TM��ʾ���ɽ�������˫������ϵ��������������º������µ����������ϳ�NH3��Ч�ʣ�ԭ��ʾ�����£�

���з������������ǣ�������
A.״̬��������������N��N����������B.�ϳ�NH3�ܷ�Ӧ��ԭ����������100%
C.��TM��LiH���ܽ��ͺϳɰ���Ӧ�ġ�HD.����NH3��2LiNH+3H2�T2LiH+2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ.���������������
A.10g��������Ϊ46%���Ҵ���Һ�к��е���ԭ����Ϊ0.6NA
B.28g��ϩ�ͱ�ϩ�Ļ�������к��е�̼ԭ����Ϊ2NA
C.2.0gD2O�к��е�����������������ΪNA
D.���ܱ�������2molSO2��1molO2��ַ�Ӧ�������к��е�ԭ����Ϊ8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() ˮ���˵���������( )
ˮ���˵���������( )
A.��ϡ��Һ�У�ˮ��ﵽƽ��ʱ�����ۼ�![]() ������Һ���Ǽ�ˮϡ�ͣ�ƽ��������ƶ�
������Һ���Ǽ�ˮϡ�ͣ�ƽ��������ƶ�
B.Ũ��Ϊ![]() ��
��![]() ������
������![]() ��Һ������������ͬʱ��
��Һ������������ͬʱ��![]() ��ˮ��̶�ǰ��С�ں���
��ˮ��̶�ǰ��С�ں���
C.����������ͬʱ��ͬŨ�ȵ�![]() ��Һ��50 ���20 ��ʱ����ˮ�⣬50 ��ʱ
��Һ��50 ���20 ��ʱ����ˮ�⣬50 ��ʱ![]() ��ˮ��̶ȱ�20 ��ʱ��С
��ˮ��̶ȱ�20 ��ʱ��С
D.Ϊ����![]() ��ˮ�⣬���õر���
��ˮ�⣬���õر���![]() ��Һ��Ӧ����������
��Һ��Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3������������������ء�
��1���������
��NH3�������ǹ�ҵ������ĵ�һ����Ӧ���仯ѧ����ʽ��______________��
�ڳ���֮�⣬��ͬ�����»����ܷ������¸���Ӧ��
4NH3��g����4O2��g����2N2O��g����6H2O��g�� ![]()
4NH3��g����3O2��g����2N2O��g����6H2O��g�� ![]()
��������Ӧ�����������ƾ��ܴ�ʵ��������Ӱ�첢����ԭ����______________��
��2���������أ�
�����صĺϳɷ��������У�
a.2NH3��g����CO2��g��![]() NH2COONH4��l��
NH2COONH4��l�� ![]()
b.NH2COONH4��l��![]() CO��NH2��2��l����H2O��l��
CO��NH2��2��l����H2O��l�� ![]()
���ܷ�Ӧ2NH3��g����CO2��g��![]() CO��NH2��2��l����H2O��l����
CO��NH2��2��l����H2O��l����![]() ��_____________��
��_____________��
����ͼΪn��NH3����n��CO2����4��1ʱ���¶ȶ�CO2��ת���ʵ�Ӱ�졣�����¶�����CO2��ƽ��ת���������ԭ��______________��
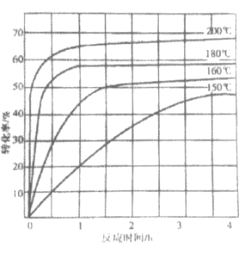
�۲ⶨ������Ʒ�������ķ������£�ȡa g������Ʒ������������ȫת��ΪNH3������NH3�ù�����v1 mL c1 mol��L��1 H2SO4��Һ������ȫ��ʣ��H2SO4��v2 mL c2 mol��L��1 NaOH��Һǡ���кͣ���������Ʒ�е�Ԫ�ص�����������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��Q��X��Y��Z��ԭ������������Q�ĵ����ǿ�������Ҫ�ɷ�֮һ��X��Qͬ���ڣ���X�Ǹ������зǽ�������ǿ��Ԫ�أ�Y��Zԭ�ӵ�����������֮��Ϊ10��Y��Z�γɵ�ij�������ӵĽṹ��ͼ��ʾ.����˵����ȷ����
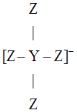
A.X��Z�ļ��⻯���ˮ��Һ��Ϊǿ��
B.Y�ĵ����ڳ����������ȶ�������ǿ�ᡢǿ�Ӧ
C.Y��Z�γɵĻ�������������½ṹ�մɲ���
D.���⻯����ȶ��ԣ�Q<X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
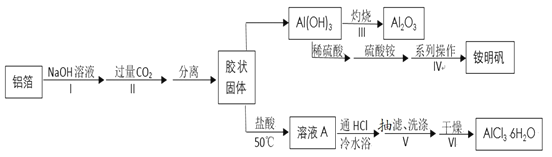
����Ŀ��ij��ȤС���������Ʊ�����Al2O3��AlCl3��6H2O����������壨NH4Al(SO4)212H2O��Ħ������Ϊ453gmol-1��������������ͼ��
��֪��a.AlCl3��6H2O������ˮ���Ҵ������ѣ�
b.�����������ɫ������������ˮ���������Ҵ���120��ʱʧȥ�ᾧˮ��280�����Ϸֽ⡣
��ش�
��1�����������ӷ���ʽΪ______��
��2�����в�����������ȷ����_____��
A.����IV�Ʊ���������������ʵ��ܽ�Ȳ���
B.����III����ʱ�轫���������������������ø���¯����������
C.����II���ɵĹ�����ó��˷����룬Ϊ�ӿ�����ٶȣ����ò������������
D.����IV�п���ѡ���Ҵ�ϴ�Ӿ��壬����ڳ�ѹ�¿��ٸ���¶�ѡ�����120��
��3������ҺA�Ʊ�AlCl3��6H2O�Ĺ�����Ҫͨ��HCl���壬��������______��д��������
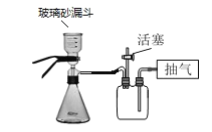
��4������V����ʱ��������ֽ��ԭ����_____��������ͼװ��ͼ���г��ˣ�����˽���ʱӦ���еIJ�����______��
��5���õ�����ƽ��ȡ2.760g��������ֲ�Ʒ����ˮ�ܽ��ȡ��ͬ�����������Һ����һ����EDTA�ζ������n(Al3+)Ϊ0.002900mol���ڶ�����BaCl2��Һ�ζ������n(SO42-)Ϊ0.006300mol�����������������Ĵ���Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ʵ�K��CaCO35��10-9��BaSO41��10-10��BaCO35��10-8��Mg(OH)25.6��10-12��Ca(OH)21.4��10-5���ȼҵ�У�������õı���ʳ��ˮ�辫�ƣ�ȥ����Ӱ���Ca2+��Mg2+��NH4+��SO42-[c(SO42-)>c(Ca2+)�������������£�ע����ҺAΪNaOH��Һ��
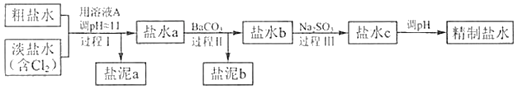
������a����ɳ�⣬�����е�������___��
�ڹ��̢��н�NH4+ת��ΪN2�����ӷ���ʽ��___��
����̢��г�ȥ��������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com