
电解CuSO4溶液时,若必须达到以下三点要求:①阳极质量减少,②阴极质量增加,③电解液中c(Cu2+)不变。则可选用的电极是
A.含Zn、Ag的铜合金作阳极,纯铜作阴极
B.用纯铁作阳极,纯铜作阴极
C.用石墨作阳极,惰性电极(Pt)作阴极
D.用纯铜作阳极,含Zn、Ag的铜合金作阴极
D
【解析】
试题分析:CuSO4溶液含有阳离子:Cu2+、H+,阴离子:OH-、SO42-,根据电解的原理,阳离子在阴极上得电子,Cu2+先放电Cu2++2e-=Cu,附着在阴电极上,阴电极质量增大;阳极的质量减少,说明活动性金属做阳极,失电子;电解液中c(Cu2+)不变,说明阴极上消耗的Cu2+等于阳极上生成的Cu2+,A、含Zn、Ag的铜合金作阳极,锌比铜活泼,锌先是电子,会使电解质溶液中c(Cu2+)减小,错误;B、铁作阳极,Fe-2e-=Fe2+,造成了电解液中c(Cu2+)减小,错误;C、石墨作阳极,石墨是惰性材料,不参加反应,质量不变,错误;D、纯铜作阳极,Cu-2e-=Cu2+,阴极上:Cu2++2e-=Cu,阴极质量增加,阳极质量减小,溶液中c(Cu2+)不变,符合题意,正确。
考点:考查电解原理。
考点分析: 考点1:电解池 试题属性

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1, 则 M可能为
A.Fe2+ B.Mg2+ C.CO32- D.Ba2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:填空题
(14分)以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 (填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为 。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)  HOCH2CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备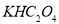 (草酸氢钾),
(草酸氢钾),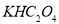 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的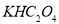 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.
B.
C.
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:实验题
50 mL 0.5 mol·L—1盐酸与50 mL 0.55 mol·L—1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(中和热是指酸和碱中和生成1 mol H2O所放出的热量)。

(1)从实验装置上看,图中尚缺少的一种用品是_________________________。
(2)烧杯间填满碎纸条的作用是____________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值将_________(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L—1盐酸跟50 mL 0.55 mol·L—1,NaOH溶液进行反应。
与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值_________(填“相等”或“不相等”),理由是___________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________(填“偏小”、“偏大”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在25℃时将两个铂电极插入一定质量的Na2SO4饱和溶液中进行电解。通电一段时间后,阴极上逸出  mol气体,同时有wgNa2SO4·10H2O晶体析出。若温度不变,则剩余溶液中溶质的质量分数为
mol气体,同时有wgNa2SO4·10H2O晶体析出。若温度不变,则剩余溶液中溶质的质量分数为

查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
Ca2+(aq)+2OH—(aq)。当温度不变时向此悬浊液中加入少量生石灰,此时下列说法正确的是
A. (Ca2+)增大 B.
(Ca2+)增大 B. (Ca2+)不变 C.
(Ca2+)不变 C. (OH—)增大 D.
(OH—)增大 D. (OH—)减小
(OH—)减小
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
可逆反应2A(g)+3B(g) 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
① (A)=0.5 mol·L—l·min—l ②
(A)=0.5 mol·L—l·min—l ② (B)=0.6 mol·L—l·min—l
(B)=0.6 mol·L—l·min—l
③ (C)=0.35 mol·L—l·min—l ④
(C)=0.35 mol·L—l·min—l ④ (D)=0.4 mol·L—l·min—l
(D)=0.4 mol·L—l·min—l
则该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:选择题
完成下列实验所选择的装置或仪器(夹持装置已略去)不正确的是
A | B | C | D | |
实 验 | 证明浓硫酸有脱水性、强氧化性及SO2有还原性、漂白性 | 用于制取纯净的氢氧化亚铁 | 用于分离NH4Cl和I2的混合物 | 用于证明铁的吸氧腐蚀 |
装 置 或 仪 器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省校高一上学期期末考试化学试卷(解析版) 题型:选择题
把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,反应现象不同的是
A | B | C | D | |
X | NaHCO3 | NaAlO2 | NaHCO3 | MgCl2 |
Y | Ca(OH)2 | HCl | HCl | NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com