
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 2 L 0.5 mol·L-1CH3COOH溶液中,CH3COO- 的数目为NA
B. 一定质量的某单质,若含质子数为n NA,则中子数一定小于nNA
C. 标准状况下,22.4LHF含有的共价键数为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
【答案】D
【解析】
A项,2 L 0.5 mol·L-1CH3COOH溶液中溶质的物质的量为2L![]() 0.5mol/L=1mol,但是醋酸为弱电解质,部分电离出CH3COO-,则CH3COO-的数目小于NA,故A项错误;
0.5mol/L=1mol,但是醋酸为弱电解质,部分电离出CH3COO-,则CH3COO-的数目小于NA,故A项错误;
B项,质子数与中子数无必然数目关系,故B项错误;
C项,在标况下HF为液体,无法计算22.4LHF的物质的量及含有的共价键数目,故C项错误;
D项,向FeI2溶液中通入一定量Cl2,Cl2会先将I-氧化,再将Fe2+氧化,当1mol Cl2被氧化时,根据溶液呈电中性可推知溶液中至少含有2mol I-,且I-全部被氧化,故转移的电子数不小于3NA,故D项正确。
综上所述,本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
D | –2价阴离子的电子层结构与Ar原子相同 |
请根据表中信息回答:
(1)A在周期表中位于第______周期______族。
(2)用电子式表示B与C形成化合物的过程:______。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)______。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.其单质在常温下呈固态
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(E)的热化学方程式__________________。
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议___________________。
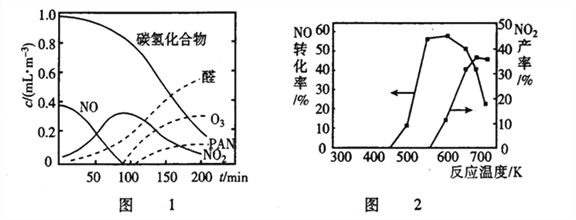
(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。
①SCR技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
②SCR技术的另一主要反应为4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
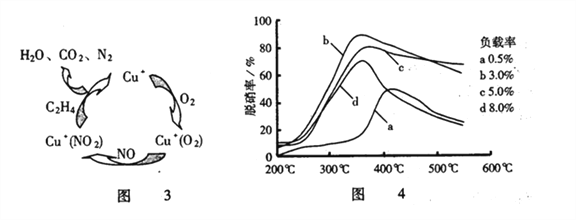
①写出该脱硝原理总反应的化学方程式______________________。
②为达到最佳脱硝效果,应选择的条件是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能形成离子键的是
A.任意两种元素之间的化合
B.活泼金属元素与活泼非金属元素之间的化合
C.两种非金属元素之间的化合
D.任何金属元素与非金属元素之间的化合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可形象地描述为交换舞伴(如图所示):

烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。根据以上信息进行判断,如果把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是 ( )
A. C6H5CH2CH=M B. CH2=CH2
C. C6H5CH2CH2C6H5 D. C6H5CH2CH=CHCH2C6H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.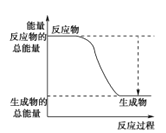 B.
B.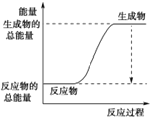
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列因果关系表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. NH3易溶于水,可用作制冷剂
C. 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板
D. 氯水中的次氯酸具有氧化性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com