
【题目】在容积为2 L的密闭容器中进行如下反应:
A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
计算:
(1)5 min末A的物质的量浓度为____________________________________________。
(2)5 min内用B表示的化学反应速率v(B)为__________________________________。
(3)化学方程式中n值为___________________________________________________。
(4)此反应在四种不同情况下的反应速率分别为
①v(A)=5 mol·L-1·min-1
②v(B)=6 mol·L-1·min-1
③v(C)=4.5 mol·L-1·min-1
④v(D)=8 mol·L-1·min-1
其中反应速率最快的是______________(填编号)。
【答案】1.5 mol·L-10.2 mol·L-1·min-12①
【解析】
(1)根据C的物质的量计算反应的A的物质的量,从而知道为反应的A的物质的量,再利用浓度公式计算;
(2)根据C的物质的量计算反应的B的物质的量,根据反应速率公式计算;
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比确定n值;
(4)把不同物质的反应速率换算成同一物质的反应速率进行比较;
开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
A(g)+2B(g) ![]() 3C(g)+nD(g)
3C(g)+nD(g)
起始量 4 6 0
变化量 1 2 3
5min末 3 4 3
(1)据以上分析可知:5 min末A的物质的量浓度为3/2= 1.5 mol·L-1 ;综上所述,本题答案是:1.5 mol·L-1。
(2) 据以上分析可知:5 min内用B表示的化学反应速率v(B)=Δc/Δt=2/2×5= 0.2 mol·L-1·min-1 ;综上所述,本题答案是:0.2 mol·L-1·min-1。
(3)根据同一反应中、同一时间段内,各物质的反应速率之比等于计量数之比:v(B):v(D)=0.2:0.2=2: n, n=2;综上所述,本题答案是:2。
(4)根据速率之比和各物质前面的化学计量系数成正比规律,把所有速率都换算成A的反应速率:
①v(A)=5 mol·L-1·min-1;
②由v(B)=6 mol·L-1·min-1可知,v(A)=3mol·L-1·min-1;
③由v(C)=4.5 mol·L-1·min-1可知,v(A)=1.5mol·L-1·min-1;
④由v(D)=8 mol·L-1·min-1可知,v(A)=4mol·L-1·min-1;
综合以上分子可知:反应速率最快的是①;综上所述,本题选①。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A. 一定得到电子B. 一定失去电子
C. 可能被氧化也可能被还原D. 以上都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C9H12O2)是合成某功能高分子材料的中间体,由C2H4和![]() 合成的路线如图所示:
合成的路线如图所示:

已知:i、RCHO+CH3CHO![]() RCH=CHCHO+H2O(R为代表烃基或氢原子)
RCH=CHCHO+H2O(R为代表烃基或氢原子)
ii、![]()
回答下列问题:
(1)试剂X的名称______________________。
(2)E的结构简式为______________________。
(3)反应④的类型是______________________。
(4)D中所含的官能团名称是______________________。
(5)写出反应⑤的化学方程式:_________________________________。
(6)同时符合下列条件的I的同分异构体共有___________种(不考虑立体异构),其中核磁共振氢谱图表明分子中有5种氢原子的为___________(写1种结构简式)。a.分子中含有苯环且苯环上有三个取代基;b.1mol有机物最多能消耗2 mol NaOH。
(7)设计以乙醛和1,3-丁二烯(CH2=CHCH=CH2)为原料制备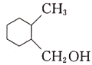 的合成路线:________ (用流程图表示,无机试剂任选)。
的合成路线:________ (用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)《2017年江苏省政府工作报告》提出“深度参与‘一带一路’建设,全面实施国际产能合作三年行动计划”。
①畅通信息丝绸之路,需要规划建设洲际海底光缆项目。生产光缆所用的光导纤维属于_______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②沪通铁路的建成将江苏沿海进一步融入上海都市圈。金属防腐是铁路建设的重要课题,下列做法的目的不是为了防腐的是_______(填字母)。
a.将钢轨打磨 b.将钢轨涂刷沥青 c.将钢轨与铝连接
③“一带一路”建设需要用大量水泥。生产水泥的主要原料为石灰石和_______(填字母)。
a.纯碱 b.石英 c.黏土
(2)芦蒿是江苏人喜爱的食材,每100g嫩茎中含有蛋白质3.6g、钙730mg、铁2.8mg、胡萝卜素1.4mg、维生素C 49mg等。

①芦蒿中属于微量元素的是_______,还缺少的给人体提供能量的营养素是________。
②β—胡萝卜素在食品工业常用作__________。
③每100g上述芦蒿嫩茎中含有的蛋白质完全水解,所得氨基酸的总质量________3.6g(填“>”、“<”或“=”)。
④维生素C能防治坏血病,又称为抗坏血酸。在维生素C溶液中滴入少量__________,可观察到溶液蓝色褪去,说明维生素C具有还原性。
(3)健康江苏2030规划纲要明确要求“实施最严格的环境保护制度,切实解决影响人民群众健康的突出环境问题”。
①下图为2017年除夕至初一全国部分城市PM2.5小时值浓度变化图。空气质量最好的城市是_________,原因是采取了烟花爆竹禁放措施;燃放烟花爆竹还会释放出大量的SO2等有害气体,写出SO2在空气中形成硫酸型酸雨的总化学方程式:___________________________。

②家庭生活要注意防止和减少对环境的污染。家居装修时要选择优质胶合板,原因是防止___________(填物质名称)产生污染;用过的聚乙烯塑料食品袋要投入贴有_________标志的垃圾箱中。
③对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。环境专家认为可以用金属镁将水体中的NO3-还原为N2,此时所得溶液呈碱性。该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室中四个装置的说明符合实验要求的是
A. 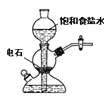 若需制备较多量的乙炔可用此装置
若需制备较多量的乙炔可用此装置
B. 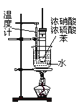 可用此装置来制备硝基苯,但产物中可能会混有NO2
可用此装置来制备硝基苯,但产物中可能会混有NO2
C. 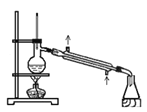 可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D.  可用此装置来制备乙酸乙酯并在烧瓶中获得产物
可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氯、溴、碘等元素,其中溴和碘在陆地上含量极少,主要存在于海水中。
(1)氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)写出有关的化学方程式_________________________________。
(2)亚氯酸钠(NaClO2)是一种漂白剂。 已知NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________________________________________。
(3)从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。氧化时常用氯气做氧化剂,写出有关的离子方程式___________________________________________________________。海带提碘时,由于碘的量较少,在灼烧、溶解之后得到的溶液用硝酸银溶液很难检验。设计一个检验溶液中是否含有碘离子的方法_________________________________________。
(4)盐酸和醋酿都是一元酸,某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如下图所示。据图判断盐酸稀释时的pH变化曲线为___________ (填“I”或“II”),溶液的导电性b ___________ c(填“>”、“<”或“=”)。水电离的c(H+)a点比b点大还是小?从电离平衡移动原理解释原因________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:
i.RCH2Br ![]() RHC=CH=R’
RHC=CH=R’
ii.RHC=CH=R’
iii.RHC=CH=R’ 
(1)A属于芳香烃,其名称是________________。
(2)B的结构简式是__________________。
(3)由C生成D的化学方程式是______________________________________________。
(4)由G生成H的反应类型是________,1molF与足量NaOH溶液反应,消耗______mol NaOH。
(5)试剂b是_______________。
(6)下列说法正确的是____(选填字母序号).
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c. 1mol G最多可以与1mol H2发生加成反应
d. 1mol F或1mol H与足量NaOH溶液反应,均消耗2molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com