
【题目】在标准状况下14.4 g CO与CO2的混合气体,体积为8.96 L。则:
(1)混合气体的密度是_________(保留三位有效数字)。
(2)混合气体的平均摩尔质量是_______。
(3)CO2和CO的体积之比_______。
(4)CO的体积分数是__________。
(5)CO2和CO的质量之比是_________。
(6)混合气体中所含氧原子的物质的量是______________。
(7)混合气体中所含碳原子的数目是_____________。
【答案】1.61 g/L 36 g/mol 1:1 0.5或50% 11:7 0.6 mol 0.4NA或2.408×1023
【解析】
(1)根据ρ=![]() 计算混合气体密度;
计算混合气体密度;
(2)根据M=![]() 计算混合气体的平均摩尔质量;
计算混合气体的平均摩尔质量;
(3)设出二者物质的量,结合质量、物质的量列式计算,再根据V=n·Vm分析;
(4)结合(3)及气体的体积比等于气体的物质的量的比,计算CO的体积分数;
(5)根据m=n·M计算二者质量之比;
(6)结合(3)及二者分子组成混合气体中所含氧原子的物质的量;
(7)结合N=n·NA计算混合气体中含有碳原子的数目。
(1)14.4 g CO与CO2的混合气体的体积为8.96 L,则混合气体的密度ρ=![]() =1.61 g/L;
=1.61 g/L;
(2)标准状况下8.96 L混合气体的物质的量n=![]() =0.4 mol,则混合气体的平均摩尔质量M=
=0.4 mol,则混合气体的平均摩尔质量M=![]() =
=![]() =36 g/mol;
=36 g/mol;
(3)设混合气体中含有的CO与CO2的物质的量分别为x、y,可得关系式x+y=0.4、28x+44y=14.4,联立解得:x=y=0.2 mol,根据阿伏伽德罗定律可知:同温同压下,气体的体积比等于二者的物质的量的比,故V(CO2):V(CO)=n(CO2):n(CO)=0.2 mol:0.2 mol=1:1;
(4)根据(3)可知,CO2和CO的体积之比为1:1,则CO的体积分数为:![]() ×100%=50%;
×100%=50%;
(5)根据(3)可知,CO2和CO的物质的量都是0.2 mol,结合m=n·M可知,二者质量与摩尔质量成正比,则CO2和CO的质量之比m(CO2):m(CO)=44 g/mol:28 g/mol=11:7;
(6)CO2和CO的物质的量都是0.2 mol,则根据O守恒可得混合气体中含有O的物质的量n(O)=2n(CO2)+n(CO)=2×0.2 mol+0.2 mol×1=0.6 mol;
(7)CO2和CO的物质的量都是0.2 mol,则混合气体中含有C原子的物质的量为n(C)= n(CO2)+n(CO)=0.2 mol+0.2 mol=0.4 mol,N(C)=n·NA=0.4 mol×NA/mol=0.4 NA或2.408×1023。


科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为
不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为![]()
![]()
![]() ,如图是高铁电池的模拟实验装置:
,如图是高铁电池的模拟实验装置:

①该电池盐桥中盛有饱和![]() 溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
溶液,此盐桥中氯离子向______(填“左”或“右”)移动。
②该电池放电时正极的电极反应式为______;充电时每转移0.3mol电子,有______mol![]() 生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。
生成,正极附近溶液的碱性______(填“增强”,“不变”或“减弱”)。

③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_________________。
(2)“![]() ”电池可将
”电池可将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为![]()
![]()
![]() 。放电时该电池“吸入”
。放电时该电池“吸入”![]() ,其工作原理如图所示:
,其工作原理如图所示:

①充电时,正极的电极反应式为________________________________。
②放电时,若生成的![]() 和
和![]() 全部沉积在电极表面,当转移0.2mol
全部沉积在电极表面,当转移0.2mol![]() 时,两极的质量差为______。
时,两极的质量差为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型银-锌电池可用作电子仪器的电源,其电极分别是![]() 和
和![]() ,电解质为
,电解质为![]() 溶液,电池总反应为
溶液,电池总反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 电池工作过程中,![]() 溶液浓度降低
溶液浓度降低
B. 电池工作过程中,电解液中![]() 向负极迁移
向负极迁移
C. 负极发生反应![]()
D. 正极发生反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
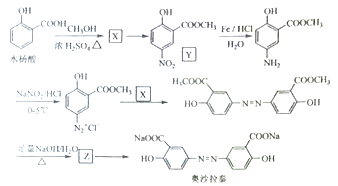
回答下列问题:
(1)X的结构简式为____;由水杨酸制备X的反应类型为_____。
(2)由X制备Y的反应试剂为_________。
(3)工业上常采用廉价的![]() ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的![]() 与Z的物质的量之比至少应为____。
与Z的物质的量之比至少应为____。
(4)奥沙拉秦的分子式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(5)若将奥沙拉秦用![]() 酸化后,分子中含氧官能团的名称为____。
酸化后,分子中含氧官能团的名称为____。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某金属氯化物MCl2 28.5 g,含有0.6 mol Cl-,则该氯化物的摩尔质量为____________,金属M的名称为____________。
(2)11.1 g CaCl2所含氯离子数与标准状况下约__________L O3所含氧原子数相等。(计算结果保留一位小数点)
(3)若a g SO2含b个原子,则阿伏加德罗常数为__________(用含a、b的公式表示)。
(4)某气体在标准状况下的密度为1.25 g/L,则 28 g该气体所含有的分子数为____________。
(5)与3.6 g水含有相同氧原子数目的硫酸的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是
A. 装置用于测定生成氢气的速率
装置用于测定生成氢气的速率
B. 装置依据单位时间内颜色变化来比较浓度对反应速率的影响
装置依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置依据 U 型管两边液面的高低判断钠和水反应的热效应
装置依据 U 型管两边液面的高低判断钠和水反应的热效应
D. 装置依据出现浑浊的快慢比较温度对反应速率的影响
装置依据出现浑浊的快慢比较温度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备金属镁的实验流程如下:

已知:一些金属离子转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)如果没有过程①,后果是:__________________________________。
(2)上述流程中被循环使用的物质是:____________。
(3)滤渣2的主要成分为:____________;溶液2中的主要溶质为:_____________。
(4)通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为________。(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(5)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O,过程③应该如何操作才能得到无水MgCl2?:_______________________________________________。
(6)写出过程④中发生反应的化学方程式:_____________________________________。
(7)为测定菱镁矿中铁的含量。称取12.5 g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如下表所示。
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①根据表中数据,可计算出菱铁矿中铁的质量分数为__________%。(保留两位小数)
②H2O2溶液应装在__________ 滴定管中(填“酸式”或“碱式”)
③误差
a.其它操作均正常,滴定终点时仰视读数会导致所测结果_________。
b.滴定之前没有排除滴定中的气泡会导致所测结果_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com