
【题目】已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是

A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用N2O4表示的平均化学反应速率是0.04 molL-1min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
【答案】D
【解析】
试题分析:由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线。A、该反应酯化反应为气体物质的量减少的反应,容器体积不变,随反应进行体系压强降低,压强不变,说明反应已达化学平衡状态,故A正确;B、由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b处于化学平衡状态,故B正确;C、由图象可知,25~30 min内用N2O4的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,所以v(N2O4)=![]() =0.04mol/(Lmin),故C正确;D、25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,故D错误;故选D。
=0.04mol/(Lmin),故C正确;D、25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称: 。
(2)SnCl2用盐酸而不用水溶解的原因是: 。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: 。
(4)反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
(5)实验室中“漂洗”沉淀的实验操作方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合成高分子化合物的说法正确的是
A. 涤纶、锦纶、蚕丝都属于合成纤维
B. 塑料、合成树脂和合成橡胶被称为“三大合成材料”
C. 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物
D. “尿不湿”中的高吸水性树脂属于功能高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )

A.AB段发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.BC段发生反应的离子方程式为H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3
D.E点时溶液中含有大量的AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体和胆矾晶体。

请回答:
(1)写出绿矾的化学式:__________________。试剂X是 。
(2)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是____________。
(3)溶液E得到绿矾晶体的实验操作 。
(4)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是__________。

(5)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式:__________________________,
请选出你认为的最佳途径并说明选择的理由:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到。
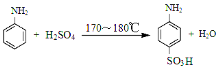
已知:100 mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可溶解6.67 g。
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成对氨基苯磺酸。实验步骤如下:步骤1:在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放在冰水中冷却,小心地加入18 mL浓硫酸。在三颈烧瓶的两个瓶口上分别装冷凝管、温度计,另一个没有使用的瓶口用塞子塞紧。将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5小时。
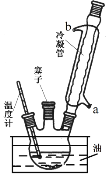
步骤2:将反应产物冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使对氨基苯磺酸晶体析出。用该烧杯中的少量冷水将烧瓶内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品。
步骤3:将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干可得纯净的对氨基苯磺酸。
(1)实验装置中冷凝管由 处(填“a”或“b”)通入冷凝水。
(2)步骤1油浴加热的优点有 。
(3)步骤2中用玻璃棒不断搅拌可促使对氨基苯磺酸晶体析出的理由是 ,用少量冷水洗涤的目的是 。
(4)步骤2和3均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先拆下连接泵和吸滤瓶的橡皮管,然后关闭水龙头,其目的是 。
(5)步骤3中若溶液颜色过深,可用 进行脱色处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.二氧化硫气体能用浓硫酸来干燥
B.胶体区别于其他分散系的本质特征是分散质粒子的直径不同
C.砖瓦、玻璃、水泥和石灰石的主要成分都属于硅酸盐
D.氨水、铵盐受热都易发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g)![]() CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
试计算:(1)H2的反应速率是多少?(2)CO的转化率为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com