
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
Ti、Fe、Ni、Cu、Zn、La等过渡金属能形成配合物或化合物与这些金属原子的电子层结构有关。
(1)基态Ni原子的外围电子排布式为 。
(2)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。其中Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。CO与N2 互为等电子体,与CO互为等电子体的离子为 (任写一种);
(3)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。试推断绿色晶体的化学式为 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图1所示,其晶胞边长为540.0 pm,则a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。


图1 图2
(6)镧镍合金有很强储氢能力,已知镧镍合金LaNin晶胞如图2,晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为___________________________________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分析题目中的图表信息,根据信息完成填空。
Ⅰ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
_______________________________________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
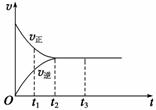
 Ⅱ. (3)下图是可逆反应X2+3Y2
Ⅱ. (3)下图是可逆反应X2+3Y2  2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 。
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 。
A.t1时,正反应速率大于逆反应速率;
B.t2时,反应达到限度;
C.t2~t3,反应不再发生;
D.t2~t3,各物质的浓度相等。
Ⅲ.以下是关于化学反应2SO2+O2  2SO3的两个素材:
2SO3的两个素材:
素材1:某温度和压强下2升容器中,不同时间点测得密闭体系中三种物质的物质的量。
|
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
素材2:反应在不同条件下进行时SO2的转化率:
(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
|
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 ℃ | 73.7 | 85.8 | 90.0 | 96.4 |
根据以上的两个素材回答问题:
(4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。
(5)根据素材2中分析得到,提高该化学反应限度的途径有:
__________________________________________________________。
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 ( )
A.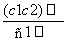 B.
B.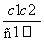
C.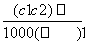 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
请填写下列物质的结晶方法。
(1)氯化钠:______________;(2)硝酸钾:______________;
(3)硫酸铜晶体:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
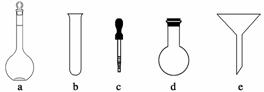
配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与能源、科技、生活、社会密切相关,下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境
B. 水电站把机械能转化为电能,而核电站把化学能转化为电能
C.化石燃料和植物燃料燃烧时放出的热量均来源于太阳能
D.植物通过光合作用将C02和H20转化为葡萄糖是太阳能转变为化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
两种非金属元素X和Y,能分别形成常见气态氢化物Q和P,Q和P都是无色刺激性气味的气体,且都极易溶于水。常温常压下,Q的密度与空气的密度之比为0.59:1。标准状况下,P的密度为1.63 g/L。Q与P能1:1化合生成盐M。
(1)元素X在周期表中的位置为__________________,M的电子式为________________。
(2)氢化物Q极易溶于水的主要原因是________________。
(3)X元素与氢元素组成分子式为HX3的化合物,该化合物能与Q以1:1化合生成盐W,盐W中阴离子的结构与CO2相似,写出该阴离子的结构式:________________。
(4)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,在水中是一种缓释强效消毒剂,请用化学方程式表示其原因:_________。
(5)某化合物由硼元素与X元素组成,化学式为BX,有多种结晶形态,其中立方结晶被认为是目前已知最硬的物质,BX立方结晶高硬度的原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com