
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 ( )
A.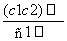 B.
B.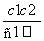
C.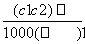 D.
D.
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
下列是关于物质结构中微粒的常见关系,正确的是
A.在含4 mol Si—O键的二氧化硅晶体中,氧原子的数目为4NA
B.金刚石晶体中,碳原子数与六碳环数之比为2∶1
C.石墨晶体中,六碳环数与碳碳键数之比为2∶3
D.氯化钠晶体中,钠离子和氯离子的配位数都为8
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;XW同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.金属性:Y>Z B.氢化物的沸点:X>W
C.离子的还原性:X>W D.原子及离子半径:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是 ( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 10 | 0.2 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
观察两个试剂瓶上的标签,回答下列问题。

(1)“5%硫酸铜溶液”中的5%是什么含义?
(2)0.4 mol·L-1 NaCl溶液中的0.4 mol·L-1表示的含义是什么?
(3)从上述两种溶液中分别取出5 mL,硫酸铜溶液的质量分数为__________,NaCl溶液的浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是 ( )
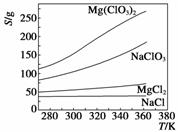
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是硫酸的试剂标签上的部分内容。某次学生实验需要
0.5 mol·L-1 H2SO4溶液480 mL,若由你来配制所需溶液,请根据
实验室已有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏:__________________________________
______________________________________________________。
(2)实验中除量筒、烧杯外还需要的其他仪器:_______________
________________________________________________________________________。
(3)计算所需浓硫酸的体积约为________mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“<”、“=”或“>”)。
(4)配制过程中需先在烧杯中将浓硫酸进行稀释。稀释的操作方法是_______________
________________________________________________________________________。
(5)下列操作会引起所配溶液浓度偏大的是________(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(6)温度计、量筒、滴定管的一部分如图所示,下述读数(虚线所指刻度)及说法正确的是________(填字母)。
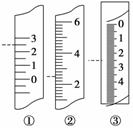
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.①是温度计,读数为2.5 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语表示正确的是( )
A.H2O、Na2O的电子式都可用“ ”表示
”表示
B.Cl、Br、I的+1价含氧酸的结构式都可用“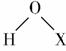 ”表示
”表示
C.乙酸、乙酸乙酯、葡萄糖的分子式都可用“CnH2nOn”表示
D.碳酸、亚硫酸的电离方程式都可用“H2XO32H++XO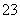 ”表示
”表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com