
下列是关于物质结构中微粒的常见关系,正确的是
A.在含4 mol Si—O键的二氧化硅晶体中,氧原子的数目为4NA
B.金刚石晶体中,碳原子数与六碳环数之比为2∶1
C.石墨晶体中,六碳环数与碳碳键数之比为2∶3
D.氯化钠晶体中,钠离子和氯离子的配位数都为8
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
D.化学反应中的能量变化通常表象为热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氢键的下列说法正确的是
A.由于氢键的作用,熔点H2O>I2
B.4℃时,水的密度最大与氢键有关
C.氢键不属于化学键,没有饱和性和方向性
D.氢键一定在分子间形成,它是一种特殊的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学用语的理解正确的是
 A.原子结构示意图
A.原子结构示意图
 表示12C,也可以表示14C
表示12C,也可以表示14C
B.球棍模型 
 表示二氧化碳分子,也可以表示二氧化氮分子
表示二氧化碳分子,也可以表示二氧化氮分子
C.电子式 
 表示羟基,也可以表示水失去氢离子剩下的部分
表示羟基,也可以表示水失去氢离子剩下的部分
D.电子排布式为1s22s22p4 表示氧元素简单阴离子,也可表示F-
查看答案和解析>>
科目:高中化学 来源: 题型:
Ti、Fe、Ni、Cu、Zn、La等过渡金属能形成配合物或化合物与这些金属原子的电子层结构有关。
(1)基态Ni原子的外围电子排布式为 。
(2)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。其中Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。CO与N2 互为等电子体,与CO互为等电子体的离子为 (任写一种);
(3)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。试推断绿色晶体的化学式为 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图1所示,其晶胞边长为540.0 pm,则a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。


图1 图2
(6)镧镍合金有很强储氢能力,已知镧镍合金LaNin晶胞如图2,晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子中,中心原子的杂化类型相同,分子空间构型也相同的是( )
A.H2O、SO2 B.BeCl2、CO2 C.H2O、NH3 D.NH3、CH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素的性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 ( )
A.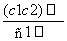 B.
B.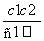
C.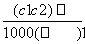 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com