
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |
 |
 |
 |
 |
 |
| 每个橡皮塞上都打了两个孔 | ||||||
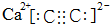 ;
;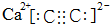 ;
;| 64g×448×10-3L |
| 22.4L |
| 1.28 |
| 1.60 |
| 5 |
| 2 |
| 5 |
| 2 |


科目:高中化学 来源: 题型:
| A、蛋白质、淀粉、纤维素和油脂都是高分子有机物 |
| B、苯和乙酸乙酯都能发生取代反应 |
| C、煤干馏可得苯及甲苯等,是由于煤中含有苯及甲苯等物质 |
| D、淀粉、纤维素和蛋白质水解都生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol
(Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| B、原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
| C、钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 |
| D、无论哪种类型的腐蚀,其实质都是金属被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com