
【题目】将![]() gNa和
gNa和![]() gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为
gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为![]() 下列说法正确的是
下列说法正确的是![]()
A.反应中放出的气体在标准状况下的体积为![]()
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中![]() 和
和![]() 的物质的量之比为2:1
的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1
【答案】D
【解析】
4.6g钠的物质的量为![]() =0.2mol,2.7gAl的物质的量为
=0.2mol,2.7gAl的物质的量为![]() =0.1mol;由2 Na+2H2O═2 NaOH+H2↑可知0.2molNa与水完全反应消耗0.2mol,同时生成0.2molNaOH和0.1molH2;生成的0.2molNaOH和0.1molAl继续发生反应2 Al+2 NaOH+2H2O═2 NaAlO2 +3 H2↑,其中NaOH过量,剩余0.1mol,同时参加反应的水为0.1mol,生成0.1molNaAlO2 和0.15molH2;
=0.1mol;由2 Na+2H2O═2 NaOH+H2↑可知0.2molNa与水完全反应消耗0.2mol,同时生成0.2molNaOH和0.1molH2;生成的0.2molNaOH和0.1molAl继续发生反应2 Al+2 NaOH+2H2O═2 NaAlO2 +3 H2↑,其中NaOH过量,剩余0.1mol,同时参加反应的水为0.1mol,生成0.1molNaAlO2 和0.15molH2;
A.因钠与水反应和铝与碱反应都放出气体,气体在标准状况下的体积为22.4L/mol×0.25mol=5.6L,故A错误;
B.因反应共消耗水0.3mol,质量为5.4g,Al的物质的量为0.1mol,质量为2.7g,故B错误;
C.因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,没有Al3+,故C错误;
D.因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,阳离子和阴离子都为1价离子,阳离子和阴离子的物质的量之比为1:1,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Phenolphthalein是常用酸碱指示剂,其结构如图所示。有关该有机物说法正确的是
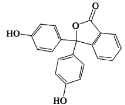
A.分子式为C20H12O4
B.含有的官能团有羟基、酯基、羧基
C.可以发生取代反应、加成反应和氧化反应
D.1mol该物质与H2和溴水反应,消耗H2和Br2的最大值分别为10mol和4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
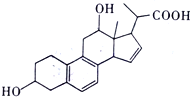
A. 该有机物的分子式为C21H24O4
B. 该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键
C. 该有机物最多消耗NaOH与NaHCO3的物质的量比为1:1
D. 1mol 该有机物与足量金属钠反应,生成33.6L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
(1)该反应的化学平衡常数_____________________。
(2)此时向容器中再通入0.7 mol CO气体,判断平衡移动的方向________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):

己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]() ;
;
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)X的名称为_________,Y中所含官能团的名称为_________ 。
(2)反应⑦的条件为_________,②的反应类型________。
(3)反应⑤的化学方程式为_________。
(4)Z的结构简式为_________ 。
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为__________。
(6) 有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。
有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。
①能发生银镜反应但不能水解。
②每摩尔同分异构体最多消耗2molNaOH。
③苯环上一氯代物只有两种。
(7)请以流程图的形式写出由T制备 的过程(无机试剂任选):(仿照
的过程(无机试剂任选):(仿照 )_____________________
)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是白色六方系晶体,剧毒,易溶于水,是HN3(氢叠氮酸,酸性与醋酸相似的弱酸)的钠盐。回答下列问题:
(1)实验室可用NaN3分解(生成两种单质)制备高纯N2,已知NA为阿伏加德罗常数的值,每生成1 mol N2转移电子数为___________。
(2)NaN3和稀硫酸反应制HN3的离子方程式为______________。
(3)NaNH2与N2O在210~220℃时反应可制备NaN3,同时放出能使湿润红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________。
(4)测定工业品叠氮化钠中NaN3质量分数的实验步骤如下:
(I)准确称量试样m g,另加少许NaOH于烧杯中,加入适量蒸馏水溶解,转移至250mL容量瓶中定容;
(II)准确移取配得的溶液20.00mL于锥形瓶中,慢慢加入V1 mL c1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后,加适量水稀释,加入5 mL浓硫酸,加2滴邻罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定到溶液由淡绿色变为黄红色(Ce4++Fe2+=Ce3++Fe3+),消耗标准溶液V2 mL。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为______。
②则样品中NaN3的质量分数为__________(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种易溶于水的白色固体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断盐的化学式分别为:A______;D______。
(2)写出下列反应的离子方程式:
①B+D→:______;
③C+HCl→气体:______。
(3)在作实验反思时,有同学提出:如果溶液中同时存在![]() 和
和![]() ,
,![]() 会对
会对![]() 的检验产生干扰。为了确定该溶液中是否存在
的检验产生干扰。为了确定该溶液中是否存在![]() ,该小组同学进行了如下探究实验:
,该小组同学进行了如下探究实验:
实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
第一步 | 向溶液中滴加过量的 | 除去 ______的干扰 | 略 |
第二步 | 向第一步实验后的溶液中滴加______ | 检验 ______的存在 | 略 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com