
| 选项 | 实验目的 | 实验方法 |
| A | 分离水和青蒿素 | 分液 |
| B | 分离乙醇和水 | 灼烧 |
| C | 分离碳酸钠和碳酸氢钠 | 过滤 |
| D | 除去碳酸钙中含有的少量氯化钙 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 元素性质或原子结构 |
| X | X的某一种原子没有中子 |
| Y | 最高正价与最低负价的代数和为0 |
| Z | 最外层电子数是周期数的3倍 |
| M | 含M元素的物质,其焰色反应为黄色 |
| G | G的简单离子半径在同周期中最小 |
| A. | X是组成有机物的必需元素 | |
| B. | Y、Z所形成的氢化物分子均含有10个电子 | |
| C. | Z的简单离子半径大于G的简单离子半径 | |
| D. | G的氧化物不溶于M的最高价氧化物所对应的水化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越弱,分子晶体的熔点越低 | |
| B. | 氯化铵受热分解,断裂离子键和共价键 | |
| C. | 金刚石、C60都不存在独立的小分子 | |
| D. | 断裂化学键,需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
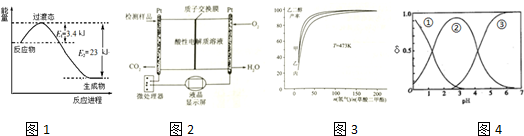
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式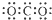 | B. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | ||
| C. | 乙烯的结构简式C2H4 | D. | Cl-的结构示意图: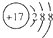 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com